вибір читачів
Популярні статті
Гостра ішемічна хвороба серця (ОІБС) - це стан, який виникає при гострому порушенні коронарного кровотоку через ураження коронарних артерій, в результаті чого розвивається гіпоксія в клітинах міокарда. При цьому стані порушується рівновага між надходженням крові в серцевий м'яз і потребами цієї серцевого м'яза на даний момент.
Провокується дана патологія найчастіше стресом або фізичним перенапруженням (в цей час міокард потребує більшої надходженні кисню, ніж його може дати надходить кров). Вікова категорія - особи похилого віку, незалежно від статі (відзначено, що чоловіки хворіють часто вже після 45 років - в 5 разів частіше жінок, а жінки - після 55 років, коли починається клімакс; тоді вони обганяють чоловіків за частотою патології).
Серед захворювань серцево-судинної системи ішемічна хвороба лідирує завжди. Як патологія, ІХС дуже поширена; соціальною проблемою вона є тому, що призводить до стійкої або тимчасової втрати працездатності або стає причиною смерті навіть в розвинених країнах світу.
Небезпека стану в тому, що нерідко воно не дає ніяких симптомів, іноді тільки можуть бути болі в серці, а потім раптом настає смерть людини без видимих, як здається, причин. Факторами стають:
Фактори ризику при ІХС майже збігаються з такими по атеросклерозу. Це відбувається тому, що основний механізм розвитку ІХС визначається змінами в судинах атеросклеротичного характеру. ІХС може розвинутися в будь-якому віці, все визначається індивідуально.

У літньому віці в переважній більшості наростають зміни в судинах: вони стають крихкими, втрачають свою еластичність, на стінках відкладаються атеросклеротичні бляшки; через неспроможність вен з'являється схильність до тромбоутворення. Все це не може не відбиватися на кровотоці.
Судини звужуються, а то і зовсім закупорюються, серцю доводиться докладати набагато більше зусиль, щоб проштовхнути кров по судинах. Обсяг крові, що надходить до серця, знижується, а значить, зменшується і кількість кисню, з'являється ішемія. Зазвичай процес розвивається повільно, але буває, що все відбувається блискавично і артерія раптово виявляється заблокованою. Стан ОІБС завжди вкрай небезпечно для життя і вимагає реанімаційних заходів.
ІХС - групове поняття. Сама ішемічна хвороба серця ділиться на гостру і хронічну - за загальноприйнятою класифікацією ВООЗ від 1979 р якою користуються і сьогодні. Розрізняють 3 форми гострої ішемічної хвороби серця:
Хронічна ішемічна хвороба серця (ХІХС) - це періодичні напади стенокардії і вона складається з 2 видів патологій: крупно-і дрібновогнищевий кардіосклерозу.
Причинами такого дисбалансу між потребами міокарда в кисні і реальним його надходженням з кров'ю можуть стати зміни всередині судин і поза ними.
Усередині посудини:
Причини поза судинами:
При цій формі можуть бути 2 види результату: з успішною реанімацією і летальним результатом. В цьому випадку напад триває дуже короткий час, протягом 1 години настає смерть. Про раптову смерть говорять тоді, коли людина до її настання мав стабільно добре самопочуття, летальний результат зафіксований протягом години і не було обставин, які могли б викликати смерть - падіння, аварія, асфіксія та ін. ІХС у таких людей проявляється по-різному: гіпертрофія міокарда, випоти, аритмії, ТЕЛА, АГ, вроджені серцеві вади і ін.

У 40% хворих смерть також стає симптомом хвороби. Причиною стають 2 моменти: зупинка серця і порушення злагодженого скорочення шлуночків. Смерть настає на місці нападу при відсутності допомоги. Такі випадки відбуваються і уві сні, коли говорять, що людина ліг спати і прокинувся.
Незважаючи на короткочасність відбувається, бувають провісники стану:
Під час нападу додаються інші симптоми:
Така картина спостерігається у сердечників зі стажем, у яких була ІХС з аритмією шлуночків, підвищення ваги, підвищений артеріальний тиск. При раптовій смерті настає раптовий різкий спазм коронарних судин і припинення роботи серця внаслідок електромеханічної дисоціації. Шлуночки починають при цьому скорочуватися хаотично, кровопостачання порушується, і через 30 хвилин повністю зупиняється зовсім.
Або ж гостра ішемія може тривати до 6 годин, а смерть настає після цього часу. Ці випадки також відносяться до першої формі. Діагноз виставляється, якщо нема інших патологій смертельного характеру у даного хворого. ЕКГ провести найчастіше не вдається через швидкість подій - не встигають це зробити. Але навіть якщо її і провели, вона малоинформативна. Закупорка артерій може відбуватися і не відразу, тоді симптоми не з'являються. На розтині у таких хворих виявляється великий повсюдний атеросклероз судин, спазм і звуження вінцевих артерій. У половини хворих виявляються в коронарних судинах тромби. Наступні інші форми ОІБС мають набагато більш тривалий перебіг.
При дистрофії міокарда в ньому розвиваються метаболічні та біохімічні відхилення, результатом чого стає порушена гемодинаміка. Це не окрема нозологія, але симптом багатьох патологій: зазвичай це серцеві патології або хвороби крові та ЦНС.
До серцевим відносять кардіоміопатії, міокардити, ішемічна хвороба серця. Друга група - анемії, отруєння і тонзиліти. Також до дистрофії міокарда привертає зловживання ліками, патології щитовидної залози і дихальної системи, Посилені фізичні навантаження протягом тривалого часу. Дистрофія серцевого м'яза може себе нічим і не проявляти, або ж відзначаються симптоми, характерні для СН: тахікардія, задишка, набряклість суглобів, завмирання серця, після навантажень - загрудінні болю.

Якщо заходів не приймати, то симптоми можуть почати зростати: біль стає розлитого характеру, гиперемиро шкіра, виступає холодний піт, починається задишка, присутнє почуття нестачі повітря і кашель. Вогнищева дистрофія частіше розвивається у спортсменів і людей похилого. Симптоми при цьому нагадують перевтома:
При своєчасно проведеній терапії стан поліпшується.
При виникла ішемії серця ця форма розвивається через 6-18 годин. Тут уже ЕКГ допомагає її виявити однозначно. Крім цього, в крові можливе виявлення ферментів пошкодженої м'язи серця - це відбувається через 12 годин з початку нападу. Причиною смерті в цих випадках стає серцева недостатність, «незаведенном» серця (немає біоелектричної активності серця), хаотична робота шлуночків.
Інфаркт міокарда - третій різновид ОІБС, в 10-15% випадках закінчується летально. Тут виникає гостра ішемія якої-небудь ділянки міокарда і подальший його некроз через повного перекриття артерій тромбами. Припиняється не тільки надходження крові в міокард, але і надходження кисню, без якого клітини міокарда не можуть довго обходитися. Вже через 30 хвилин починаються некротичні процеси в тканинах.
Відмирання клітин міокарда триває 3-6 годин. Ось чому цей часовий проміжок є золотим при порятунку хворого. Смерть може наступити за 18 годин з початку захворювання, але інфаркт можливо виявити через добу після початку нападу. При цьому в міокарді спочатку розвивається некроз тканини, потім її рубцювання. Складна класифікація ІМ залежить від локалізації ішемії, терміну виявлення. За зоні некрозу він буває дрібно- або великовогнищевим, інтрамуральним (коли уражається вся серцевий м'яз).

При ІМ можуть розвиватися фібриляція шлуночків, серцева недостатність, аневризма аорти. Всі зазначені стани можуть викликати смерть хворого. Найчастіше ІМ розвивається гостро, після фізичних навантажень. Його ознаки:
Навіть якщо є не всі перераховані симптоми, а тільки частина з них (сильні тривалі загрудінні болю, пітливість, блідість і ціаноз шкіри), звернення до лікаря обов'язково. Якщо хворий під час нападу знепритомнів і сталася зупинка серця, крім виклику швидкої, необхідне проведення непрямого масажу серця і штучного дихання для підтримки кровообігу. Якщо хворий у свідомості, до приїзду швидкої треба покласти під язик хворого таблетку нітрогліцерину. Хворий повинен розжувати таблетку аспірину і випити 15-20 крапель корвалолу.
Велике значення набувають своєчасні реанімаційні заходи. Якщо хворий не помер в машині швидкої допомоги і був доставлений в реанімацію, йому проводиться лікування в стаціонарі: проведення знеболювання, налагодження ритму серця, видалення тромбу, відновлення кровотоку.
Після реанімації проводиться лікування у відділенні терапії з підключенням всіх необхідних препаратів під наглядом кардіологів. Потім, в кінці лікування в стаціонарі починається, і триває вже вдома процес реабілітації із заняттями ЛФК, який розтягується ще на кілька місяців. Для виключення рецидивів, хворому доведеться повністю поміняти свій спосіб життя.
Слід мати на увазі, що ІХС - патологія хронічна, вона неухильно прогресує - це головна її тенденція. Лікування, навіть саме правильне і своєчасне, може тільки зупинити або сповільнити розвиток захворювання, але звернення процесу назад неможливо. Тому краще не допускати його появи, ніж довго потім лікувати.
Ліки, що усувають проблеми з серцем
Факти про серце. Раптова серцева смерть
Ішемічна хвороба серця
Ішемічна хвороба серця стенокардія, гострий інфаркт міокарда Симптоматика, діагностика +)
Ішемічна хвороба серця (гостра форма) - стан, що характеризується порушенням функції міокарда внаслідок зниження кровотоку через коронарні артерії. Гостра форма захворювання провокується найчастіше фізичним навантаженням або стресовою ситуацією, коли серце вимагає більшого припливу крові. ІХС - одна з найбільш поширених причин смерті у всіх країнах світу.
Є вкрай небезпечним станом для життя. Вимагає негайного медичного втручання.
Ішемічна хвороба серця (ІХС) - патологічний стан, викликане нестачею кисню в клітинах міокарда.
Розвиток хвороби відбувається наступним чином:
Ішемічна хвороба серця може розвиватися повільно, якщо блокування артерій відбувається поступово, але іноді зміни проходять блискавично і артерія раптово стає заблокованою.
Такий стан називають гострим інфарктом міокарда.
Хронічна форма може протікати безсимптомно, але на електрокардіограмі (ЕКГ) подають ознак ураження серця. Гостра форма захворювання супроводжується утрудненим диханням, блідими губами, тахікардією та сильним болем в лівому підребер'ї.
Інфаркт міокарда як форма гострої ішемічної хвороби серця є вкрай небезпечним станом для життя. Виникає при різкому припиненні припливу крові до серця, викликаючи пошкодження серцевих тканин. Це, як правило, є результатом закупорки однієї або декількох коронарних артерій. Патологія може розвинутися через накопичення речовини, що складається в основному з жирових клітин, холестерину і продуктів клітинних відходів.
Класичні ознаки серцевого нападу проявляються як біль у грудях і задишка, але симптоми захворювання можуть бути дуже різні.
Найбільш поширені ознаки включають в себе:
Слід зазначити, що не всі люди при інфаркті міокарда відчувають схожі ознаки. Біль в грудях є найбільш часто зустрічається симптомом серед жінок і чоловіків.
Медична статистика показує, що жінки частіше, ніж чоловіки, відчувають:
Деякі жінки відчувають ознаки захворювання, схожі на звичайний грип, але результати ЕКГ показують ознаки ураження серця.
Серце - головний орган серцево-судинної системи організму, яка також включає в себе різні види кровоносних судин. Найбільш важливі з них - коронарні артерії. Їх функція полягає в доставці крові, багатої киснем, до всіх органів організму, в тому числі - до серця.
Коли ці артерії стають заблокованими або звуженими через накопичення ліпоїдного нальоту, потік крові до серця може значно зменшитися або повністю припинитися.
Це може стати причиною інфаркту міокарда.
До закупорці коронарних артерій наводять такі чинники:
Ряд чинників збільшують ризик розвитку інфаркту міокарда.
Люди, які мають такі захворювання, перебувають в групі ризику:
Інші фактори, які можуть збільшити ризик інфаркту міокарда, включають в себе:
Для того щоб визначити інфаркт міокарда, лікар прослуховує серце на наявність відхилень в серцебитті. Наступний крок - вимір артеріального тиску. Електрокардіограма (ЕКГ) вимірює електричну активність серця.
ЕКГ є найбільш простим і інформативним способом діагностики, який виявляє і записує електричну активність серця.
Тест показує, як швидко б'ється серце і його ритм (постійний або нерегулярний). ЕКГ також записує силу і терміни електричних сигналів, оскільки вони проходять через серце.
ЕКГ застосовується, щоб: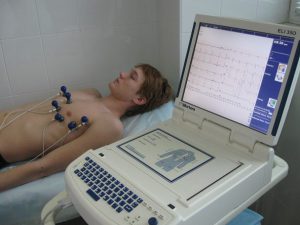
ЕКГ може показати ознаки пошкодження серця через ішемічної хвороби і ознаки попереднього або поточного серцевого нападу.
Для діагностики проблем в роботі серця проводять функціональні ЕКГ із застосуванням фізичного навантаження і лікарських засобів. ЕКГ робиться під час роботи пацієнта на біговій доріжці або велотренажері. Такі тести допомагають виявити ознаки коронарної недостатності і дозволяють відрізнити їх від некоронарних змін.
Перед проведенням ЕКГ слід уникати використання жирних кремів або лосьйонів для поліпшення контакту електродів з шкірою і отримання коректного результату дослідження.
Аналізи крові використовуються для перевірки білків, які пов'язані з пошкодженням серця.
Інші діагностичні тести містять у собі: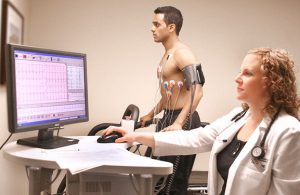
Дотримання профілактичних заходів (фізичні навантаження, здоровий спосіб життя, правильне харчування) І виконання всіх призначень лікаря допоможуть уникнути цього стану.
Виключені: стенокардія (I20.-) минуща ішемія міокарда новонародженого (P29.4)
I24.0 Коронарний тромбоз, що не приводить до інфаркту міокарда
Коронарна (артерії) (вени). емболія\u003e не приводять. оклюзія\u003e до інфаркту. тромбоемболія\u003e міокарда Виключений: коронарний тромбоз хронічний або встановленої тривалістю більше 4 тижнів (більше 28 днів) від початку (I25.8)
I24.1 синдром Дресслера
Виключена: ішемічна хвороба серця (хронічна) БДУ (I25.9)
Він включає в себе різноманітні клінічні форми і стану, як гострі, так і хронічні, як оборотні, минущі, так і незворотні, які закінчуються ушкодженням і загибеллю серцевих клітин. Виявляється ІХС, як правило, тоді, коли ступінь звуження (стенозирования) коронарної артерії досягає не менше 50%, а виражені напади стенокардії напруги - при звуженні просвіту до 70-80% і більше. Причому частіше і раніше уражається передня міжшлуночкової артерія. Крім атеросклеротичного ураження артерій у патогенезі ІХС беруть участь і інші чинники, зокрема стан внутрішньої стінки судин (ендотелію) і тих хімічних сполук (ендотеліальних факторів), які постійно виробляє ендотелій в процесі своєї життєдіяльності.
Грають роль і тромбоцитарний фактори, і спазм судин, і гормональний дисбаланс, і порушення метаболічних процесів (порушення обміну ліпідів, білків, вуглеводів і т.д.), і ще різноманітні фактори, багато з яких до кінця не вивчені, а інші не вивчені взагалі. Так чи інакше, основними факторами патогенезу ІХС на сьогоднішній момент вважаються - атеросклероз судин, спазм коронарних артерій, минущі тромбоцитарний агрегати (скупчення тромбоцитів). Які ж конкретні форми може приймати ішемічна хвороба серця? Про це ми і поговоримо докладніше.
розрізняють декілька форм ішемічної хвороби серця. За класифікацією ВООЗ, першою формою ІХС є раптова коронарна смерть (Або первинна зупинка кровообігу). На жаль, це досить часта причина загибелі досить молодих і активних людей. За визначенням, це ненасильницька смерть, що сталася несподівано протягом 6 годин у здаються здоровими людей. У цьому визначенні відображена сутність цієї форми
- люди, начебто не жалующееся ні на що, раптом падають і вмирають. Іноді вони дійсно нічого не відчувають, проте найчастіше перші ознаки можна було запідозрити, відчути і прийняти необхідні (іноді самі елементарні) заходи запобігання катастрофи. Згодом ми розберемо це детальніше.
Другою формою ІХС є інфаркт міокарда. При інфаркті міокарда у хворого, внаслідок порушення кровообігу в тій чи іншій зоні, розвиваються незворотні зміни в серцевих клітинах (кардиомиоцитах), з подальшою загибеллю цих клітин і утворенням рубця в зоні некрозу (загибелі) кардіоміоцитів. інфаркт - тема дуже велика і складна, ми досить докладно зупинимося на ній.
Ще однією розповсюдженою (і широко відомої) формою захворювання є стенокардія. Це одна з найпоширеніших форм ІХС, і, на жаль, саме стенокардія найчастіше лікується неадекватно, незважаючи на величезну кількість інформації з лікування цього захворювання. порушення серцевого ритму можуть бути обумовлені не тільки атеросклерозом та ішемічною хворобою серця. Вони викликаються також запальними захворюваннями міокарда, підвищенням вмісту в крові стресових гормонів і ще багатьма факторами, але при ІХС їх виникнення обумовлено саме наявністю вогнищ ішемії міокарда, що робить цю проблему досить складною для вирішення. Чому це так, ми обговоримо у відповідних випусках розсилки.
недостатність кровообігу - ще одна велика проблема кардіології. І знову ми маємо те, що недостатність кровообігу (НК, серцева недостатність) - це не тільки форма ІХС, а й прояв інших захворювань. І лікується це часто також неадекватно, причому якщо у випадку зі стенокардією інформації з лікування більш ніж достатньо, то підходи до лікування серцевої недостатності за останнім часом серйозно змінилися, а інформація про це у лікарів часто відсутня. Але почнемо ми, природно, з раптової коронарної смерті.
Раптова коронарна смерть
Вона становить, за різними авторам, 70 - 90% всіх випадків раптової смерті від різних причин нетравматичний походження. Головною причиною раптової коронарної смерті є, безумовно, ІХС. ВКС у чоловіків зустрічається частіше, ніж у жінок: співвідношення померлих чоловіків і жінок досягає 10: 1. Це перевищує аналогічне співвідношення з будь-якого іншого захворювання серця. Тобто у чоловіків набагато більше шансів, ніж у жінок, померти раптово, ніж отримати інфаркт або іншу коронарну катастрофу.
Безпосередньою причиною ВКС найчастіше є фібриляція шлуночків. Це порушення серцевого ритму, при якому серце скорочується не як єдине ціле, а відбуваються неузгоджені хаотичні скорочення окремих серцевих волокон і груп волокон, причому частота серцевого ритму досягає 300-600 скорочень в хвилину. Зрозуміло, що такий стан абсолютно неефективно з точки зору адекватності кровообігу і не сумісне з життям.
Іншими причинами раптової смерті є асистолія (тобто зупинка серця, відсутність серцевих скорочень) і електро-механічна дисоціація. Фактори ризику раптової смерті. Одним з основних факторів ризику досі залишається паління. У групі раптово померлих осіб молодше 50 років не було жодного некурящого, 95% з них курили дуже багато. Механізм куріння складний і складається з численних факторів. Особливо ризик зростає у тих, хто починає курити до 20 років і у жінок. Іншим дуже важливим фактором ризику є збільшення (гіпертрофія) лівого шлуночка серця. Цей стан виникає при підвищеному тиску, У осіб з надмірному вагою, при деяких вадах серця. Механізм, в основному, пов'язаний з підвищенням нестабільності електричних процесів у збільшеному серці, а також з тим, що збільшення числа м'язових волокон не супроводжується пропорційним зростанням коронарних судин і тому кровотік в серцевому м'язі стає відносно неадекватним тій м'язовій масі, Яку йому (кровотоку) треба забезпечити кров'ю і киснем.
Також фактором ризику ВКС є і розширення (дилатація) серця і ознаки дисфункції серцевого м'яза. Діагностика цих станів проводиться по ЕКГ, ЕхоКГ, рентгенологічно, за допомогою сцинтиграфії міокарда, ізотопної вентрикулографії, а також іншими методами дослідження серця. Потрібно врахувати, що всі ці дослідження не замінюють і не скасовують лікарського огляду і розпитування, але дозволяють об'єктивно оцінити вираженість змін і визначити прогноз захворювання. Важливими чинниками ризику є значна артеріальна гіпертензія, особливо кризового перебігу, чоловіча стать (про це ми вже говорили) і стрес, особливо на тлі підвищеної активності симпатичного відділу вегетативної нервової системи.
Є також і ЕКГ-ознаки підвищеного ризику раптової смерті. Раніше їм приділялося велике значення, особливо прогностическому значенням шлуночкових екстрасистолій. була розроблена спеціальна класифікація Лауна і співавторів, по якій намагалися оцінювати ступінь ризику життєво небезпечних аритмій серця. Зараз медики вже далеко не такі категоричні, багато поглядів на ризик і прогноз аритмій в даний час переглянуті і переглядаються, однак деякі специфічні ознаки до цих пір не втратили свого значення. У поєднанні з клінічною картиною, ЕКГ залишається дуже важливим механізмом у визначенні ризику раптової коронарної смерті.
Найбільш важливими і небезпечними в прогностичному плані зараз вважаються порушення функції лівого шлуночка середнього або важкого ступеня (які документуються Ехо-КС і ізотопними дослідженнями), а також виявляється на коронарографії звуження досить великої кількості коронарних артерій. Якщо до того ж у такого пацієнта виявляються порушення серцевого ритму, такий пацієнт повинен розглядатися як загрозливий по раптової смерті і йому обов'язково повинна проводитися наступальна програма профілактики раптової смерті.
Передвісники раптової смерті
Це досить складне питання. На жаль, великий відсоток померлих раптово не мали ніяких попередніх ознак, які могли б вказувати на такий розвиток подій. Однак, з огляду на, що раптова смерть досить рідко розвивається у людей, які не мають коронарної патології, ми можемо в деякій мірі орієнтувати загрозливих по ВС хворих на настороженість щодо свого здоров'я.
1) Особливу групу складають особи, які перенесли інфаркт міокарда. Найчастіше, саме ці люди і мають провісники ВС. Вони можуть відчувати стомлюваність, посилення відчуття задухи і тиску в області грудини, тяжкості в плечах. Хочу відразу ж обмовитися, що далеко не кожне відчуття задухи або стомлюваності може бути передвісником подібного розвитку подій, не варто лякатися кожного подібного погіршення самопочуття. Настороженість повинна бути перш за все щодо симптомів, які не мають зв'язку з будь-якої зрозумілої причиною і в осіб, що мають вираженої порушення коронарного кровообігу (звідси стає зрозуміла важлива роль коронарографії у визначенні прогнозу захворювання).
Крім того, ризик раптової смерті значно підвищується у курців і зазнають значні стреси людей. Зміни частоти і характеру больових нападів також дуже істотно для адекватної оцінки стану. Подібні стани (вони називаються нестабільною стенокардією), як не дивно, нечасто призводять саме до раптової смерті, але вони завжди вимагають до себе найпильнішої уваги і з боку пацієнтів, і з боку лікарів, так як вони можуть закінчуватися повторними інфарктами, що саме по собі вкрай неприємно.
Виявлено, що майже у половини пацієнтів цієї групи, в день настання смерті відзначалися подібні симптоми, в середньому за 3,5 години до гостро розвиненого стану. Такі хворі мають шанси на порятунок при своєчасно розпочатої терапії, тому необхідно досить уважно ставиться до свого здоров'я. Як не сумно, нерідко провісники ВС бувають виражені більш ніж достатньо, проте ніяких заходів вжито не було. Трохи пізніше ми обговоримо які саме заходи повинні прийматися в таких випадках.
2. Друга група осіб, особливо загрозливих по раптової смерті, це особи, у яких виявляються ішемічні зміни ЕКГ (Або ішемія міокарда, що виявляється іншими способами), але відсутні больові відчуття або будь-які інші симптоми. Найчастіше, у них уражена передня стінка лівого шлуночка. У таких хворих дуже високий ризик раптової смерті внаслідок виникають життєво небезпечних порушень ритму. Ситуація ускладнюється тим, що такі хворі часто не знають про наявність у себе такого захворювання і не вживають відповідних заходів, а якщо і знають про свій стан, через відносно нормального самопочуття не надають великого значення профілактиці та лікуванню захворювання.
3. До цієї групи належать особи, у яких не можна визначити гострі ушкодження міокарда. Більшість з них не має ніяких провісників, і визначити ймовірність розвитку у них ВС неможливо. На жаль, на жаль, бувають і такі ситуації. Допомогти можна тільки екстреними лікарськими заходами. У нашій країні організація допомоги таким хворим відстає від розвинених країн на добрий десяток років, де першу лікарську допомогу надають крім медиків самі громадяни і парамедичні бригади (поліція, пожежники), які володіють навичками реанімації на рівні, недоступному більшості дипломованих медиків у нашій країні.
Методи профілактики раптової смерті.
Основним принципом профілактики ВС, на мій погляд, є інформування пацієнтів про їх стан. Тобто, якщо люди знають про можливість неприємних ускладнень з боку свого захворювання, вони більш уважні до змін в самопочутті, активніше приймають медикаменти, уважніше ставляться до рекомендація лікарів. Зусилля лікарів в цих ситуаціях спрямовані насамперед на стабілізацію електричних явищ в серце.
Для цих цілей використовується постійний прийом дезаггрегантов (аспірину, куранти, пармідін), антиоксидантів, предуктала. Дуже широко застосовується призначення бета-блокаторів (обзидана, віскі, атенололу та ін.). Вважається, що бета-блокатори навіть більш ефективні в профілактиці раптової смерті, зумовленої порушеннями ритму, ніж власне антиаритмічні препарати. Крім того, лікування маніфестує ІХС саме по собі є профілактичним заходом щодо ВС.
Призначення ж власне антиаритмічної терапії вимагає вдумливого підходу. Це окрема тема, в будь-якому випадку вирішувати питання про початок антиаритмічної терапії і підборі препаратів повинен завжди лікуючий лікар. Крім цього, хворий повинен враховувати ряд моментів, що стосуються його поведінки в різних критичних ситуаціях.
Хворі, у яких високий ризик розвитку раптової смерті, повинні, по можливості, уникати ситуацій, що пред'являють підвищене навантаження на серцево-судинну систему. Категорично забороняються індивідуальні заняття фізкультурою і спортом (при тому, що певні рухові навантаження для них життєво необхідні). Такі люди потребують постійного спостереження лікаря ЛФК, і тільки лікар може дозволити збільшити або змінити інтенсивність і характер фізичних навантажень.
Забороняється куріння, особливо після (або під час) фізичних навантажень або стресів. Не рекомендується довго вести автомобіль, довго перебувати в задушливому приміщенні, по можливості, слід уникати тривалих перельотів на літаку. Якщо людина віддає собі звіт в тому, що його реакція на стрес неадекватна, надмірна, надлишкова, має сенс проконсультуватися з психологом і виробити адекватний спосіб реагування на стресові подразники. Не допускається переїдання або одномоментне вживання великої кількості жирної, «важкої» пиши.
Як бачите, поради досить прості й очевидні, але, незважаючи на це, дуже дієві, і тому не варто вважати все це зазіханням на особисту свободу, так як порівняно невелика свідоме обмеження своїх звичок і потреб може на роки продовжити Ваше життя і зберегти Ваше здоров'я .
Інфаркт міокарда.
Інфаркт міокарда - це важке захворювання, що характеризується загибеллю частини скорочувальних клітин міокарда з подальшим заміщенням загиблих (некротизованих) клітин грубою сполучною тканиною (тобто формуванням постінфарктного рубця). Загибель клітин (некроз) відбувається в результаті триваючої ішемії міокарда та розвитком незворотних змін в клітинах внаслідок порушення їх метаболізму.
Найбільш загальна класифікація міокарда має на увазі виділення крупно-і дрібновогнищевий інфаркту (за розмірами вогнищевого ураження), різних варіантів локалізації некротичного вогнища інфаркту міокарда (зазвичай кажуть - локалізація інфаркту міокарда), а також гострого, підгострого періодів і періоду рубцювання (за часом і стадіях перебігу) . Крім цього, виділяють ще кілька критеріїв, за якими також проводиться класифікаційне виділення різних форм інфаркту, але все це ми розглянемо докладніше по ходу обговорення. Поки ж нам потрібно визначитися з загальними закономірностями виникнення і перебігу інфаркту міокарда.
інфаркт - захворювання завжди гостре і етапне, чи йде мова про інфаркт міокарда, інфаркті легкого або інфаркті нирок. Відносно інфаркту міокарда (ІМ) можна відзначити, що в першу добу зона інфаркту зовні (якби у нас була б можливість подивитися на серце) ніяк не відрізняється від здорових ділянок міокарда. Зона інфаркту в цей час носить мозаїчний характер, тобто серед загиблих клітин зустрічаються також частково або навіть повністю працездатні міоцити (серцеві клітини). На другу добу зона поступово відмежовується від здорової тканини і між ними формується періінфарктной зона.
Часто в периинфарктной зоні виділяють зону осередкової дистрофії, що межує з некротичної зоною і зону оборотної ішемії, що примикає до ділянок неушкодженого міокарда. У зоні осередкової дистрофії всі структурні та функціональні зміни в більшості випадків можуть бути відновлені (частково або навіть повністю). У зоні оборотної ішемії зміни можуть бути повністю оборотні. Після відмежування зони інфаркту надходить поступове розм'якшення і розчинення загиблих міоцитів, елементів сполучної тканини, ділянок судин, нервових закінчень. Приблизно на 10 добу при крупноочаговом інфаркті міокарда на периферії вогнища некрозу вже є молода грануляційна тканина, з якої в подальшому буде формуватися сполучна тканина, що виконує рубець.
Замісні процеси йдуть від периферії до центру, тому в центрі вогнища якийсь час можуть ще залишатися вогнища розм'якшення, а це ділянка, здатний розтягуватися, формуючи аневризму серця або навіть розриватися при грубому недотриманні рухового режиму або інших порушеннях. Щільна рубцева тканина в місці некрозу остаточно формується приблизно через 3-4 місяці і пізніше. При мелкоочаговом інфаркті міокарда рубець може утворюватися в більш ранні терміни. Швидкість рубцювання залежить не тільки від розмірів вогнища некрозу, а й від стану коронарного кровообігу в міокарді взагалі і в періінфарктной ділянках особливо.
Крім цього, мають значення вік хворого, рівень артеріального тиску, руховий режим, стан обмінних процесів, забезпеченість пацієнта повноцінними амінокислотами, вітамінами. адекватність проведеного лікування, наявність супутніх захворювань. Все це визначає інтенсивність відновлювальних процесів в організмі взагалі і в міокарді зокрема.
Для чого ми так детально розглядали анатомічні (вірніше, правильніше буде сказати, морфологічні) зміни в серцевому м'язі при інфаркті міокарда? Справа в тому, що мені хотілося б дати вам уявлення про те, що відбувається в серці насамперед для того, що ви змогли зрозуміти - інфаркт має свою досить чітку фазову, стадийную структуру.
Не можна проскочити якусь стадію, можна лише по можливості скоротити її в часі. Тому при лікуванні інфаркту потрібно, по-перше, налаштуватися на досить тривалу терапію, і по-друге, чітко уявляти собі, що фактори, які в одному періоді не мають істотного значення, в іншому періоді можуть зіграти фатальну роль у розвитку захворювання.
Скажімо, навіть порівняно невелике навантаження в період формування первинного рубця (при певних умовах, природно), може призвести до розвитку аневризми серця (випинання стінки шлуночка, формування своєрідного мішка), а вже через місяць та ж навантаження виявляється корисною і навіть необхідною для зміцнення серцевого м'язи і формування більш міцного рубця. Але продовжимо розмову про інфаркт. І поговоримо зараз про те, як проявляється гострий великовогнищевий (тобто найбільш типовий) інфаркт міокарда.
Клінічна картина інфаркту міокарда.
Найхарактернішим симптомом інфаркту міокарда є біль. болі в типових випадках локалізуються в лівій частині грудної клітини, За грудиною, іноді у верхній частині живота або під лопаткою. Класичним випадком вважається сильна загрудинний біль, тривалістю понад 30 хвилин, не знімається нітрогліцерином (НЕ нітратами! Іноді, на жаль, в популярних посібниках трапляються опису клініки інфаркту, в яких вказана, що біль «не знімається нітратами». В поняття нітратів входять і нітропрепарати тривалої дії, такі як сустак або нитронг, тому такий опис може тільки вводити людину в оману. Йдеться тільки про препарат дуже швидкої дії - нітрогліцерині.
Навіть нитросорбид, застосовуваний під язик, як нітрогліцерин, не є достатньо швидким препаратом, хоча і його можна використовувати, якщо під рукою немає нітрогліцерину). Правда, подібна типова картина буває далеко не завжди, і далеко не кожен випадок подібних болів обумовлений розвиваються інфарктом міокарда. Іноді замість болю з'являється відчуття печіння, помірного тиску, стиснення за грудиною, в грудній клітці.
Часто болю протікають хвилеподібно, які тривалий час, то кілька слабшаючи, навіть припиняючись, то знову посилюючись. Часто болю не мають чітких меж і носять розлитої, поширений характер. Вважається, що болі при інфаркті не повинні бути пов'язані з актом дихання. Однак це буває не завжди і, на жаль, часто призводить до запізнілої діагностики інфаркту міокарда, так як лікарі не асоціюють ці болі із серцевою патологією. Це тим більш прикро, що подібна симптоматика буває, як правило, при великих і глибоких інфарктах міокарду і пояснюється виникають реактивним подразненням плеври.
Крім больового синдрому для інфаркту міокарда характерні й інші ознаки, такі як зниження артеріального тиску (в ряді випадків інфаркт міокарда може протікати при підвищеному тиску, особливо у гіпертоніків відносно молодого віку, але це зустрічається рідше, і в цьому випадку падіння артеріального тиску відбувається отсроченно, через кілька годин і навіть днів).
Зниження АТ залежить від падіння скорочувальної здатності серця, коли ділянки міокарда, що потрапили в інфарктну зону, втрачають свою здатність до скорочення і перестають працювати. Звідси зрозуміло, що чим більше зона інфаркту, тим виражене буде падіння скоротливості серця і тим значніше буде зниження артеріального тиску.
Таке грізне ускладнення інфаркту міокарда, як кардіогенний шок розвивається тільки при дуже великих і глибоких інфарктах, коли зі скорочення вимикається до 40% і більше робочого міокарда. Чим нижче рівень артеріального тиску у хворого з інфарктом міокарда, тим серйозніше прогноз захворювання. Одночасно з падінням артеріального тиску може розвиватися і почастішання ритму, тахікардія. Знову ж таки зазначу, тахікардія виникає не завжди, і не завжди це несприятлива ознака, але, все ж, небезпека аритмій у хворого без почастішання ритму помітно вище, ніж у того, у кого розвивається помірна тахікардія.
Часто у хворих розвиваються і вегетативні порушення: м'язове тремтіння, нудота, блювота, порушеннями сечовипускання, холодний піт, задишка. Хворі відчувають страх смерті, виражене занепокоєння, тривогу, іноді розвиваються навіть психічні порушення. Ці зміни можуть залежати від розмірів ураженого вогнища (внаслідок адекватної розміром некрозу гиперкатехоламинемии, т. Е. Збільшення викиду в кров гормонів - адреналіну і інших) або, рідше, не носити прямої кореляції з розмірами некрозу.
У будь-якому випадку, не варто особливо орієнтуватися на вегетативно-психічні зміни при оцінці тяжкості інфаркту (хоча, звичайно, тяжкість стану хворого безпосередньо залежить і від ступеня вираженості подібних явищ). Крім того, існують і кілька різних психологічних реакцій людини на що виникає у нього інфаркт міокарда. Мається на увазі не тільки перша реакція у вигляді страху, невпевненості в благополучному результаті і т.д. але і подальші зміни в психіці, безпосередньо пов'язані з розвитком хвороби і усвідомленням людини свого стану.
Тут є дуже багато різних нюансів, але потрібно знати, що існують нормальні (адекватні) психологічні реакції і патологічні (невротичні) психологічні реакції на захворювання.
Нормальні психологічні реакції на що виникає інфаркт можуть бути трьох типів: знижена психологічна реакція (з елементами анозогнозии - заперечення), середня реакція і підвищена психологічна реакція.
при зниженою реакції відзначається недостатньо критична оцінка свого стану, кілька підвищений настрій не відповідає ситуації, однак не порушується поведінка хворого, немає психопатологічних симптомів, немає відмови від лікування, тому така реакція може вважатися адекватною, нормальною. Таке, свого роду «заперечення захворювання» може бути і своєрідною психологічною реакцією людини на хворобу, проте такі хворі мають потребу в гарній психологічній роботі з боку лікаря. Вони схильні до недооцінки свого стану, що може призводити до порушення з їх боку режиму і лікарських приписів.
Підвищена психологічна реакція також не супроводжується психопатологічними порушеннями поведінки і також вважається нормальною (хоча і надлишкової) реакцією на хворобу. При цій реакції фон настрою, навпаки, знижений, хворі схильні песимістично розглядати свої перспективи на одужання і подальшу долю. Такі хворі часто недовірливі, ретельно стежать за своїм станом, стурбовані своєчасним прийомом ліків і дотриманням рекомендацій.
Часто вони цікавляться народними і нетрадиційними методами лікування (нагадую, що мова йде не тільки про гострої реакції на виникнення інфаркту, але і про досить тривалої реакції, що формується у хворих, які перенесли подібну серцеву катастрофу). Необхідно ретельно і сумлінно працювати з такими пацієнтами, щоб сформувати у них нормальне, адекватне ставлення до свого здоров'я (і до своєї хвороби), налаштувати їх на одужання, сформувати у них позитивну позицію, не допускати того, щоб такі хворі більше довіряли недобросовісним «цілителів », ніж кардіологів, подібні захворювання накладають вкрай високу відповідальність на лікаря і неграмотне, безвідповідальне лікування тут неприпустимо.
при середньої психологічної реакції ставлення хворого до свого здоров'я цілком свідоме, він адекватно здатний оцінювати свій стан, правильно ставитися до лікарських приписами. Вони усвідомлюють серйозність становища, проте не впадають у відчай і депресію. На жаль, подібна реакція зустрічається не так часто, як хотілося б, оскільки саме захворювання досить серйозно і одне слово «інфаркт» вже формує у людей відповідні асоціації.
Патологічні реакції на інфаркт міокарда. як правило, зводяться до п'яти типів:
1) кардіофобіческой реакція. Хворі відчувають страх «за серце», боязнь повторних інфарктів, раптової смерті від серцевого нападу. З'являється страх навіть перед мінімальною фізичною активністю. Страхи можуть з'являтися (або різко посилюватися) раптово, часто вони супроводжуються вегетативними проявами - тремтінням в тілі, пітливістю, слабкістю, серцебиттям в серце. Особливістю таких реакцій є те, що вони дуже погано піддаються раціональному переконання і роз'ясненнями. Звичайно потрібно терпляча, тривала психотерапевтична робота в поєднанні з медикаментозною терапією.
2) Депресивна реакція. Пригнічений, пригнічений настрій, апатія, безнадія, песимізм, невіра у власне одужання, тенденція бачити все в похмурих тонах. Подібна реакція рідко, але може досягати досить вираженому ступені, і тоді потрібна термінова консультація психіатра, так як на цьому фоні можуть виникати суїцидальні думки. До цього тлі може додаватися тривога (варіант депресивної реакції - тривожно-депресивна) за справи, залишені на роботі, за благополуччя сім'ї, за результат захворювання, і тоді в психічному статусі наростають внутрішня напруженість, дратівливість, неспокій, порушується сон.
Такі хворі нерідко вельми докучають родичам і медперсоналу своїми нескінченними питаннями і тривогами, але саме вони, як ніхто, потребують уважного, турботливого і терплячому ставленні. Іноді саме неправильна поведінка медиків в тій чи іншій мірі провокує розвиток депресивних реакцій у хворих.
3) Іпохондрична реакція. Явна переоцінка тяжкості свого стану, невиправдане занепокоєння за своє здоров'я, безліч різноманітних скарг, виражена невідповідність між числом скарг і незначністю об'єктивних змін, надмірна фіксація уваги на своїх відчуттях. Елементи іпохондрії можуть спостерігатися у досить великого числа осіб, які перенесли інфаркт, але до ступеня клінічної стадії це доходить порівняно нечасто.
4) Істерична реакція. Для хворого характерні егоцентризм, демонстративність. емоційна лабільність (рухливість), прагнення привернути до себе увагу оточуючих, викликати співчуття. спостерігаються вегетативні розлади, особливо «на публіці». У особливо істероїдних особистостей можуть розвиватися виражені неврологічні порушення, аж до «істеричного паралічу», з розвитком характерною неврологічної симптоматики. Правда, серед людей, які перенесли інфаркт виражена істерична реакція зустрічається вкрай рідко.
5) анозогнозіческій реакція. Заперечення хвороби з ігноруванням лікувальних рекомендацій і грубими порушеннями режиму. Незважаючи на те, що зустрічатися з такими хворими реально доводиться нечасто, за статистикою, кожен десятий випадок патологічних реакцій на інфаркт, полягає а запереченні свого захворювання. Працювати з такими хворими завжди дуже складно, тут велику роль відводиться оточенню хворого, його сім'ї.
Таким чином, ми розглянули первинні нормальні і патологічні реакції на гострий інфаркт міокарда. Ці реакції розвиваються безпосередньо в гострий період інфаркту міокарда, а також під час перебування хворого в стаціонарі. Після того, як хворий виписується із стаціонару і потрапляє додому, психологічна ситуація навколо хворого, а також психологічний стан самого хворого, змінюється. Настає друга фаза психологічної реакції на інфаркт міокарда.
Якщо в період стац. лікування хворий повинен адаптуватися безпосередньо до самого факту наявності у себе важкого захворювання, з досить несприятливим прогнозом і хронічним перебігом, то після виписки хворий повинен адаптуватися вже до наслідків хвороби. Психологічний стан в цей період досить часто погіршується. У стаціонарний період хворий постійно оточений увагою, турботою, знаходиться під постійним лікарським наглядом, знаходиться в лікарняних умовах, де повсякденні турботи відходять як би на другий план. Після виписки ж, він стикається з численними життєвими проблемами - сімейними, побутовими, виробничими і т.д.
Виникає тривога з приводу подальшого життя, - чи буде він переведений на інвалідність, як існувати далі, які навантаження для нього можуть бути небезпечні і чим він зараз може займатися, що буде з його родиною і багато інших проблем дуже сильно впливають на психологічний стан хворого. Більш того, відсутність щоденного лікарського контролю також сприяє занепокоєння за своє здоров'я.
До того ж, не секрет, що в наших поліклініках практично ніхто психологічним станом здоров'я таких пацієнтів не цікавиться і не займається, і хворі, найчастіше, залишаються один один зі своїми проблемами. Типи психологічних реакцій відповідають типам розглянутих нами первинних психологічних реакцій. Первинні реакції можуть в таких випадках посилюватися, до наявної картині можуть приєднуватися симптоми інших реакцій - з'являються змішані клінічні типи реакцій.
Однак, при правильно обраної тактики лікування, вже наявні психологічні реакції найчастіше нівелюються, поліпшується загальне самопочуття, зменшуються симптоми психічної астенії, з'являється впевненість у своїх силах. У багатьох випадках цьому сприяє триступенева схема реабілітації: стаціонар - санаторій - поліклініка.
Отже, з психологічними особливостями клінічною картиною розвивається інфаркту міокарда ми більш-менш розібралися. Нагадаю, що, крім психологічних нюансів, ми розглянули особливості больового синдрому інфаркту міокарда та прояви порушень у вегетативній сфері організму.
Ще одна група симптомів обумовлена всмоктуванням некротичних мас з ураженого міокарда. Ці симптоми відображають розміри зони некрозу і динаміку що відбуваються в ній змін, їх нерідко об'єднують терміном резорбціонний синдром.
Зокрема, вже в кінці першої-початку другої доби починає підвищуватися температура тіла. Це пов'язано з резорбцією (тобто всмоктуванням в кров) некротичних мас. Потрапляючи в кров, ці некротичні маси розносяться по організму, викликаючи своєрідне отруєння організму, його інтоксикацію. Тому поява температурної реакції після важкого больового нападу має велике діагностичне значення, особливо при диференціальної діагностики з важким приступом стенокардії.
Температура тіла досягає максимальних величин на 2-4-е добу, зазвичай не перевищує 38-39 ° С і при неускладненому перебігу нормалізується в другій половині першого тижня, іноді до кінця її. Деякі клініцисти вважають, що за ступенем гіпертермії (підвищення температури тіла) можна судити про розміри вогнища некрозу і, отже, прогнозувати перебіг інфаркту міокарда.
В якійсь мірі це дійсно так, проте гіпертермія в значній мірі залежить від загальної реактивності організму. Зокрема, навіть при дуже великих вогнищах некрозу в літньому і старечому віці, а також у ослаблених осіб з важкими супутніми захворюваннями вона може підвищуватися несуттєво, а відновлювальні процеси в зоні некрозу, рубцювання інфаркту міокарда при цьому протікають мляво і повільно.
Наявність температурної реакції понад тиждень може вказувати на те, що протягом інфаркту міокарда стає несприятливим, що виникає затяжне або рецидивуючий перебіг або що він ускладнився тромбоемболією, пневмонією, іншими захворюваннями. При більш тривалому підвищенні температури можливий розвиток постінфарктного синдрому (синдром Дресслера) або інших ускладнень. Вже до кінця першої доби інфаркту міокарда по периферії вогнища некрозу скупчуються лейкоцити, переважно нейтрофіли, що володіють найбільшою активністю.
В цей же час в периферичної крові виявляється лейкоцитоз з нейтрофільний зсув вліво. Лейкоцитоз в більшій мірі, ніж температура, відображає розміри некротичного вогнища, однак абсолютної залежності між цими показниками не існує. У деяких випадках виражена лейкоцитарна реакція навіть при великому інфаркті міокарда відсутня, що може свідчити про дуже слабку реакцію організму на різноманітні стресові фактори і зустрічається у літніх і старих людей, а також в ослабленому організмі. Відсутність адекватної реакції лейкоцитів на розвиток інфаркту міокарда може зумовити недостатню активність репаративних (тобто відновних, загоюють) процесів і затяжний перебіг захворювання.
Важливо відзначити, що в перші дні розвитку інфаркту міокарда в периферичної крові значно знижується кількість еозинофілів аж до їх повного зникнення - анеозінофілія. У міру інтенсифікації репаративних процесів їх число збільшується. Швидкість осідання еритроцитів (ШОЕ) починає зростати через 1-3 діб після виникнення захворювання і зберігається на підвищеному рівні 3-4 тижні, іноді довше. Нормалізація ШОЕ зазвичай вказує на завершення неспецифічного запального процесу в зоні некрозу.
Збільшена ШОЕ пізніше цих строків свідчить або про затяжному або рецидивуючому перебігу інфаркту міокарда, або про приєднання ускладнень. У зв'язку з тим що число лейкоцитів в кінці першої - початку другого тижня з моменту початку інфаркту міокарда знижується, а ШОЕ ще продовжує зростати, криві, що відображають динаміку даних показників, перетинаються. Цей типова ознака інфаркту міокарда прийнято називати «ножицями».
І шеміческая хвороба серця (ІХС) (синонім: коронарна хвороба серця) являє собою гостре або хронічне захворювання, що виникає внаслідок зменшення або припинення кровопостачання міокрада в зв'язку з поразкою в системі коронарних артерій. Це визначення ВООЗ (1969) відображає основний механізм розвитку ІХС - невідповідність між потребою міокарда в кисні і можливістю доставки його через коронарні артерії.
Класифікація (ВООЗ). Виділено такі основні форми ішемічної хвороби серця: 1) гострий інфаркт міокарда; 2) інші гострі і підгострі форми; 3) хронічна форма. Стенокардія як основний симптом захворювання в свою чергу підрозділяється на стабільну і нестабільну.
Стабільна стенокардія представлена двома основними формами: а) стенокардія напруги; б) стенокардія спокою і напруги. Поява нападів стенокардії спокою вказує на погіршення перебігу захворювання, бо свідчить про недостатню доставку кисню міокарду в умовах спокою. Нестабільна стенокардія займає проміжне положення між хронічної ІХС і гострим інфарктом міокарда. Характерна особливість цієї форми - нестабільність коронарного кровообігу по клінічним і ЕКГ-ознаками з минущими ішемічними змінами. У 20-40% хворих нестабільна стенокардія трансформується в інфаркт міокарда.
Частота ІХС придбала за останні десятиліття характер епідемічного захворювання в більшості країн світу, а смертність від неї займає перше місце серед всіх інших причин. У США від ІХС та її ускладнень щорічно помирає понад 600000 чоловік. Поширеність хвороби, як і смертність, особливо великі серед чоловіків у віці від 45 до 65 років; у жінок захворювання починається на 10-15 років пізніше, ніж у чоловіків. Найбільш часта причина смерті - інфаркт міокарда і його ускладнення.
Етіологія і патогенез. ІХС, як правило, розвивається при стенозирующем атеросклерозі коронарних артерій. У 92-94% хворих на розтині виявлено атероскле-ротические зміни коронарних артерій, а результати прижиттєвої селективної коро-нарографіі показують, що звуження різного ступеня виявляються у 85% хворих з клінічною картиною захворювання. Розвиток атеросклерозу у вінцевих артеріях має ті ж закономірності, що й в інших відділах судинної системи. Початкові атеросклеротичні зміни з'являються вже у віці 15-20 років, а в 40-45 років вони бувають значно виражені, причому у 3/4 хворих спостерігається звуження тільки однієї коронарної артерії більш ніж на 75% просвіту. Особливостями атеросклеротичного ураження вінцевих артерій є: 1) локалізація в області проксимальних відділів великих, субепікардіально розташованих гілок коронарних артерій; 2) сегментарний характер ураження судини на протязі 1-5 см; 3) збереження задовільною або хорошої прохідності судини дистальніше зони ураження.
Етіологічними факторами ІХС можуть служити різні патологічні процеси: емболія тромботическими масами, аневризма аорти із здавленням усть коронарних артерій. Всі ці різноманітні за своєю природою патологічні процеси і в першу чергу атеросклероз викликають порушення кровотоку по вінцевих артеріях і лежать в основі патогенезу захворювання.
Патологічна анатомія. Вінцеві артерії зазнають змін, характерні для різних стадій розвитку атеросклеротичного процесу: від субінтімальних ліпідних відкладень до різко звужують просвіт судини бляшок і тромбозу з повною оклюзією судини. За частотою ураження на першому місці стоїть передня низхідна артерія, на другому - права коронарна артерія, на третьому - огинає гілка лівої коронарної артерії і далі йде стовбур лівої коронарної артерії. У 75% хворих спостерігається множинне атеросклеротичнеураження вінцевих артерій. Прохідність русла коронарних артерій дистальніше звуження збережена в 88% спостережень, але при множинних ураженнях анатомічні умови для реконструктивних операцій на всіх змінених коронарних артеріях є тільки в 30% випадків. Причина цього - нерівномірність розповсюдження і розвитку атеросклерозу по ходу судини в дистальному напрямку. При діабеті і вираженої гіпертонії дистальні відділи коронарних артерій частіше бувають вражені атеросклерозом.
Міокард зазнає морфологічні зміни в залежності від форми і стадії ІХС. У гострих стадіях інфаркту міокарда спостерігаються вогнища некрозу різних розмірів, поступово заміщаються рубцевої тканиною з розвитком постінфарктного кардіосклерозу. Ускладненнями гострого інфаркту є: розрив міжшлуночкової перегородки і освіту її дефекту; розрив зовнішньої стінки лівого шлуночка з кровотечею в перикард і тампонадой; некроз папілярного м'язу, що веде до недостатності мітрального клапана; аневризма лівого шлуночка. Кардіосклероз може розвинутися без попереднього інфаркту внаслідок порушення кровопостачання міокарда при різко вираженому звуженні вінцевих артерій серця - атеросклеротичний кардіосклероз. Поряд з процесами склерозу і фіброзу міокарда спостерігається компенсаторна гіпертрофія міокарда.
Патофізіологія ішемії міокарда. Серце забезпечується кров'ю правої і лівої вінцевими артеріями. Кровотік по цих судинах становить в середньому 80 мл / хв на 100 г речовини міокарда. Основні особливості миокардиального кровотоку і метаболізму: 1) велика частина крові надходить в міокард під час діастоли; 2) внутріми-кардиальное тиск під час систоли найбільш високо в субендокардіальних шарах лівого шлуночка, а діаметр перфорує міокарда судини малий, що збільшує опір кровотоку; 3) в нормі м'яз серця екстрагує 75% кисню, і подальше збільшення надходження кисню може бути досягнуто тільки за рахунок зростання коронарного кровотоку, чому перешкоджає стеноз вінцевої артерій при атеросклерозі. Необхідність збільшення споживання кисню визначається численними факторами: фізичне навантаження, стрес, тахікардія, тонус міокарда та ін. При відсутності можливості забезпечити надходження достатньої кількості крові розвивається дисбаланс і виникає ішемія міокарда.
Звуження вінцевої артерії грає роль в зменшенні кровотоку в тому випадку, коли воно досягає 75% просвіту і більш. У цих умовах будь-яке підвищення потреби в збільшенні кровотоку, як, наприклад, фізичне навантаження, не може бути реалізовано і наслідком є ішемія міокарда.
У клінічних умовах час переходу оборотних ішемічних змін в інфаркт варіює в широких межах, що залежить від багатьох факторів: а) швидкості розвитку оклюзії; б) наявності компенсаторних механізмів, головним з яких є колатеральний кровообіг. У нормі в міокарді існує мережа колатералей, однак кровотік в них невеликий, а ретроградний тиск становить 15 мм рт. ст. У міру зниження антеградного кровотоку в коронарній артерії внаслідок повільно наростаючого стенозу зростає градієнт тиску, збільшується ретроградний кровотік і діаметр колатералей, які можуть забезпечувати на належному рівні кровопостачання ішемізованих областей міокарда. Розрізняють внутрішньосистемні, т. Е. В межах басейну однієї артерії, і міжсистемні колатералі. Останні забезпечують перетікання з системи лівої вінцевої артерії в праву або назад. При швидкої оклюзії (тромбоз, спазм, емболія коронарної артерії) колатералі функціонально недостатні і не можуть захистити міокард від ішемічного некрозу - розвитку інфаркту міокарда.
Діагностика. Основний клінічний прояв ІХС - больовий синдром - стенокардія (грудна жаба). Типова ангінозний біль виникає у вигляді нападів, локалізується за грудиною, частіше у верхній її третини, рідше в нижній третині або надчеревній ділянці. Біль виникає після навантаження, триває 3-5 хв і проходить в спокої. Найбільш діагностично достовірна реакція на прийом нітрогліцерину: зазвичай через 1-2 хв біль стихає або проходить. Можуть мати місце і менш типові прояви стенокардії у вигляді дискомфорту в грудях, відчуття нестачі повітря, тахікардії, порушень ритму і почуття страху. Характерна іррадіація болю в одну або обидві верхні кінцівки, під лопатку, в шию.
При прогресуванні атеросклеротичного процесу в коронарних артеріях напади стенокардії виникають в спокої, вночі, при зміні положення тіла, під час і після їжі. По тяжкості клінічних проявів - частоті і виразності нападів стенокардії - можна судити про ступінь ураження коронарного русла.
Клінічний перебіг стенокардії хвилеподібно. Періоди щодо стабільного стану можуть змінюватися переходом в більш важку форму - нестабільну стенокардію. Діагностичними критеріями нестабільної стенокардії служать наступні ознаки: 1) різке загострення звичної стенокардії, виникнення нападів тривалістю 15-20 хв при відсутності провокуючих чинників; 2) виникнення нападів тривалістю 15-20 хв і більше у осіб, що не страждали раніше стенокардією; 3) слабо виражений ефект або його відсутність від застосування нітрогліцерину; для купірування нападу доводиться вдаватися до наркотиків або нейролептанальгетікам; 4) минуща ішемія міокарда по ЕКГ-ознаками: депресія сегмента ST, інверсія зубця Т, але відсутність патологічного зубця Г; 5) нормальний або злегка підвищений рівень ферментів в крові, відсутність лейкоцитозу і збільшення ШОЕ.
Виділено наступні групи хворих з нестабільною стенокардією: а) вперше виникла - від декількох днів до 3 міс; б) стенокардія після перенесеного інфаркту міокарда як в гострому, так і підгострому періоді; в) нестабільна стенокардія на тлі хронічного перебігу захворювання; г) передінфарктний стенокардія (стан загрозливого інфаркту міокарда).
Стенокардія типу Принцметала - варіантна форма, для якої характерні приступи болю в спокої, часто вночі, і відсутність нападів у відповідь на навантаження. Напади стенокардії Принцметала обумовлені важким спазмом вінцевих артерій і часто супроводжуються ознаками субепікардіаль-ного пошкодження міокарда за даними ЕКГ.
Інфаркт міокарда - прояв гострого розладу коронарного кровообігу з некрозом зони міокарда різної локалізації. Клінічні прояви складаються з ряду симптомів: гостра тривалий біль за грудиною; порушення ритму; зміни гемодинаміки і симптоми серцевої недостатності.
Кардіогенний шок при інфаркті міокарда представляє одну з гострих форм недостатності кровообігу, обумовлену поразкою значної маси міокарда та додатковими факторами, до яких відносяться порушення ритму, периферичні судинні реакції, зниження органного кровотоку в печінці, нирках, головному мозку. Основні клінічні симптоми шоку: зниження систолічного артеріального тиску до 80 мм рт. ст .; блідість і похолодання шкірних покривів; олігурія менше 20 мл / год або анурія; загальмованість і сплутаність свідомості.
Серцева недостатність є частим клінічним симптомом ІХС. При гострих формах ІХС серцева недостатність, переважно лівошлуночкова, починається як кардіальна астма, набряк легенів. При хронічних формах ІХС недостатність кровообігу наростає поступово внаслідок крупноочагового кардіосклерозу, постінфарктної аневризми лівого шлуночка, постінфарктної мітральноїнедостатності. При постінфарктному дефекті міжшлуночкової перегородки швидко наростаюча недостатність кровообігу - основний симптом.
При неускладнених формах ІХС стенокардія є основним симптомом, і дані фізикального дослідження надзвичайно мізерні: огляд, аускультація, пальпація не виявляється будь-яких відхилень від норми. Під час нападу може виникнути патологічний III тон. Систолічний шум вказує на дисфункцію папілярного м'язу, нерідко він вислуховується при кардіосклерозі. Грубий систолічний шум, який виник в перші дні гострого інфаркту міокарда, є наслідком постінфарктної мітральноїнедостатності або розриву міжшлуночкової перегородки. Для останнього характерний шум з епіцентром у правого краю грудини, тоді як шум мітральної недостатності проводиться в пахвову западину зліва. В цілому при об'єктивному дослідженні хворого необхідно звертати увагу на рівень артеріального тиску, порушення ритму, наявність шуму над серцем і великими судинами. Всі ці дані дозволяють скласти уявлення про ознаки атеросклерозу взагалі і ураженні серця.
На ЕКГ в спокої - недостатність коронарного кровообігу при різних формах ІХС, порушення ритму і провідності, пошкодження і некрози міокарда. Разом з тим у багатьох хворих ЕКГ в спокої може бути нормальною. Електрокардіографія в умовах фізичного навантаження (велоергометрія) виявляє коронарну недостатність у зв'язку з відсутністю необхідного коронарного резерву. Критеріями позитивної проби з навантаженням вважають підйом інтервалу ST в стандартних відведеннях більш ніж на 1 мм, а в грудних відведеннях - більш ніж на 2 мм.
Рентгенологічне дослідження при ІХС не виявляється будь-яких спеціальних симптомів. Воно важливе для діагностики аневризми серця і серцевої недостатності як прояви ускладнень ІХС (застій в малому колі, розширення порожнин серця, набряк легенів).
Селективна коронарографія є найбільш точним методом топічної діагностики атеросклеротичного ураження вінцевих артерій серця, дозволяючи визначити ступінь звуження і його локалізацію, стан периферичного русла вінцевих артерій і стан колатерального кровообігу.
Селективна коронарографія показана як заключна діагностична процедура при відборі хворих на ішемічну хворобу серця на операцію. Крім того, вона показана хворим з підозрою на вроджену аномалію вінцевих артерій серця, при постінфарктної аневризмі лівого жедулочка або іншому ускладненні інфаркту - дефект міжшлуночкової перегородки. Особливо необхідна коронарографія при підозрі на стеноз стовбура лівої коронарної артерії. У хворих на ІХС, які перенесли фібриляцію серця, коронарографія необхідна для з'ясування причин цього ускладнення. В цілому коронарографія важлива для вибору методу лікування хворого ІХС з важкої клінічною картиною і при недостатній ефективності медикаментозного лікування.
Ліву вентрикулографію виробляють одночасно з коронарографією. Вона дозволяє оцінити контрактільную функцію по якісному і кількісному аналізу вентрікулограмми. Комплексна оцінка даних коронарографії та вентрикулографии необхідна для встановлення точних показань до хірургічного лікування.
Радіонуклідне дослідження коронарного кровотоку і перфузії міокарда (сканування на гамма-камері, нуклідний ветрікулографія) дозволяє оцінити ступінь порушення кровопостачання міокарда, його функціональний стан, уточнити показання до операції і визначити потім її ефективність.
Лікування. Вибір методу лікування заснований на ретельній оцінці кожного хворого, з'ясуванні тяжкості ураження коронарного русла і ефективності медикаментозного лікування, а також знанні прогнозу природного перебігу захворювання. Медикаментозне лікування включає комплекс препаратів: нітрогліцерин, нітрати пролонгованої дії, В-блокатори і антагоністи кальцію. Необхідно нормалізувати артеріальний тиск, знизити масу тіла, відмовитися від куріння.
Основним методом хірургічного лікування різних форм ІХС є пряма реваскуляризація міокарда: маммарокоронарного анастомоз і аутовенозне аортокоронарне шунтування. Обидва види реваскуляризації міокарда мають певні переваги і обмеження. Тому вибір методу заснований на досвіді і залежить від того, скільки уражених вінцевих артерій необхідно шунтировать.
При множині шунтуванні 3-4 артерій використовують аутовеной. Можливо комбіноване втручання із застосуванням маммарокоронарного анастомозу і венозного аортокоронарного шунта.
Показання до операції при хронічній ІХС визначають, оцінюючи тяжкість стенокардії і її стійкість до медикаментозному лікуванню; ступінь і локалізацію звуження вінцевих артерій; скоротливу функцію міокарда.
Стенокардія спокою і напруги, стійка до медикаментозного лікування, є основною клінічною показанням до операції. Об'єктивним критерієм тяжкості стенокардії служить позитивна проба і низька толерантність до фізичного навантаження (менше 400 кгм / хв). Поразка коронарного русла зі звуженням артерії на 75% і більше є анатомічним чинником, що визначає необхідність реваскуляризації міокарда. Остання показана в тому випадку, якщо міокард в зоні ураженої артерії життєздатний і не заміщений великим трансмуральним рубцем. Ішемічна дисфункція міокарда служить показанням до операції.
Звуження стовбура лівої коронарної артерії на 70%, ураження трьох вінцевих артерій є найбільш важливим показанням до операції, так як смертність цих хворих при природному перебігу вище, ніж при хірургічному.
Протипоказання до операції загальні - супутні важкі захворювання легенів, печінки, нирок, головного мозку, постійне АТ вище 180/100 мм рт. ст. Вік старше 70 років не є протипоказанням при загальному хорошому стані хворого. При надлишковій масі тіла (понад 90 кг) із застосуванням відповідної дієти можна домогтися зниження маси тіла і потім виконати операцію: Місцеві протипоказання: ураження дистальних відділів коронарних артерій, діаметр вінцевих артерій менше 1,5 мм, зниження фракції викиду лівого шлуночка менше 0,30 , якщо воно не викликане аневризмою або постінфарктним пороком мітрального клапана, дефектом міжшлуночкової перегородки.
Прогноз. Зникнення стенокардії після операції настає у 70% і у 15-20% хворих спостерігається значне поліпшення. Реваскуляризація міокарда призводить до збільшення толерантності до фізичного навантаження, покращує якість життя. У 40% хворих поліпшується контрактильна функція міокарда. Хороші результати операції пов'язані з функцією шунтів. Рання прохідність шунтів становить 75-85%, а прохідність трансплантата з внутрішньої грудної артерії ще вище - 90%. З плином часу кількість прохідних шунтів знижується щорічно на 2-3% внаслідок прогресування атеросклеротичного процесу або в результаті фіброзу інтими шунта.
ХВОРОБИ СЕРЦЯ. ІШЕМІЧНА ХВОРОБА СЕРЦЯ. Гіпертензивний хвороба серця. ГІПЕРТРОФІЯ міокарда. ГОСТРЕ І ХРОНІЧНЕ ЛЕГЕНЕВА СЕРЦЕ
Ішемічна хвороба серця (ІХС) - це група захворювань, що виникають внаслідок ішемії міокарда, викликаної відносної або абсолютної недостатністю коронарного кровообігу. В основі цього захворювання лежить атеросклеротичне звуження просвіту вінцевих артерій.
Захворювання широко поширене. Тому за рішенням ВООЗ з 1965 р ІХС розглядається в якості самостійної нозологічної групи в Міжнародній класифікації хвороб.
Аналогічні ІХС зміни в міокарді можуть виникати без атеросклеротичного ураження вінцевих артерій серця. Наприклад, в результаті різних васкулітів, тромбоендокардіта, міокардитів. Вони розглядаються не як самостійні захворювання, а як ускладнення відповідного патологічного процесу.
ІХС є серцевою формою атеросклерозу і гіпертонічної хвороби (виступаючих в якості фонових захворювань). В основі її лежать ті ж причини, що і при цих патологічних станах. Для ІХС виділяють фактори ризику 1-го порядку. при поєднанні яких ймовірність захворювання досягає 60%. До них відносять гіперліпідемію, артеріальну гіпертензію, куріння, гіподинамію, чоловіча стать хворого.
До факторів ризику 2-го порядку відносять: літній вік, огрядність, стреси, порушення обміну речовин типу цукрового діабету, подагри, дефіцит магнію, селену, цинку, гіперкальціємія.
Перебіг ІХС хронічне з епізодами гострої коронарної недостатності, в зв'язку з чим виділяють часто патогенетично тісно пов'язані між собою гостру і хронічну форми захворювання.
Причинами цих захворювань можуть бути: 1) тривалий спазм; 2) тромбоз; 3) емболія; 4) функціональне перенапруження міокарда при стенозирующем атеросклерозі вінцевих артерій і недостатньому коллатеральном кровообігу.
Спазм атеросклеротически зміненої артерії може привести до крововиливу і пошкодження фіброзної покришки бляшки, що активує тканинний тромбопластин, що стимулює агрегацію тромбоцитів. В результаті формується пристінковий або обтуруючий тромб, що викликає зупинку кровотоку.
стенокардія (Angina pectoris, грудна жаба) характеризується нападами давили, що стискають, рідше колючих болей в області серця, обумовлених короткочасної ішемією міокарда лівого шлуночка. Виділяють наступні види стенокардії.
Стабільна форма (стенокардія напруги) зустрічається найчастіше. В основі захворювання лежить стенозуючий атеросклероз вінцевої артерії, що призводить до тривалої ішемії. Серцевий м'яз стає чутливою до будь-якої функціональної навантаженні. Напади зазвичай проходять через кілька хвилин спокою або після прийому судинорозширювальних медикаментозних препаратів.
стенокардія спокою (Стенокардія Принцметала) розвивається в спокійному стані хворого - у спокійному стані, під час сну. Характерний спазм вінцевих артерій серця (навіть без наявності атеросклеротичних бляшок), що приводить до трансмуральної ішемії міокарда. Тривалість нападу може досягати 15-30 хв.
нестабільна форма проявляється частими наростаючими нападами (при фізичному навантаженні і в стані спокою) великої тривалості. В основі лежить руйнування атеросклеротичної бляшки з пристінковим тромбозом вінцевих артерій, можливі ангіоспазм, емболія. Деструктивні зміни фіброзної бляшки можуть бути викликані спазмом вінцевої артерії, що руйнують бляшку, тривалої тахікардією, гіперхолестеринемією і крововиливом в бляшку.
Такий стан часто передує інфаркту міокарда, воно отримало назву передінфарктної стенокардії, або гострої коронарної недостатності, в міокарді можливий розвиток мікроінфарктів. Прохідність артерії може відновитися внаслідок довільного або обумовленого медикаментозними препаратами лізису тромботичних мас, дозволу ангиоспазма.
при стенокардії морфологічно відзначаються набряк міокарда, дистрофія кардіоміоцитів зі зменшенням вмісту глікогену в цитоплазмі. Ці зміни оборотні, часто повторювані напади призводять до розвитку дифузного мелкоочагового кардіосклерозу.
Раптова коронарна смерть. До цього патологічного стану відносять смерть, що настала в перші 6 годин після виникнення гострої ішемії міокарда в результаті фібриляції шлуночків.
Обов'язковою умовою є відсутність будь-яких інших хвороб, що викликають швидку смерть. В основі лежить тривалий спазм атероск-леротіческі стенозірованних вінцевих артерій серця або їх тромбоз. У молодих людей без атеросклеротичних змін смерть може розвинутися в результаті спазму вінцевих артерій серця при вживанні наркотика кокаїну. Наявність екстрасистолій вдвічі підвищує ризик раптової коронарної смерті.
Раптова серцева смерть включає крім коронарної, раптову смерть при міокардитах, кардіоміопатії, вадах розвитку вінцевих артерій, вроджених вадах серця, коарктації аорти.
Серце хворого в'яле, з розширеною порожниною лівого шлуночка з крапковими крововиливами в міокарді. найбільш характерним мікроскопічним ознакою є фрагментація м'язових волокон. Причиною служить пересокращеніе дистрофически змінених м'язових волокон. на ультраструктурному рівні видно пошкодження сарколеми кардіоміоцитів, деструкція мітохондрій. У вінцевих артеріях серця виявляють плазматичне просочування, ліпідну інфільтрацію і крововиливи в фіброзних бляшках, надриви інтими і деструкцію еластичних мембран, що свідчить про коронароспазм. Характерно нерівномірне кровонаповнення капілярів: від повного запустеванія в ділянках ішемії до повнокров'я і дрібних крововиливів в оточуючих областях.
Інфаркт міокарда - судинний некроз серцевого м'яза.
за локалізацією виділяють інфаркт передньої, задньої і бічної стінок лівого шлуночка, міжшлуночкової перегородки, верхівки серця і обширний інфаркт.
По відношенню до шару серцевого м'яза розрізняють трансмуральниі. субендокардіальний, інтрамуральний і субепікардіальниі інфаркт міокарда.
Залежно від тимчасових особливостей виникнення можна говорити про 1) первинному (гострому) інфаркті міокарда, що протікає протягом 4 тижнів (28 днів) до формування рубця, 2) повторному, розвивається через 4 тижні після гострого (коли на місці первинного інфаркту виникає постінфарктний кардіосклероз) і 3) рецидивирующем. наблюдающемся протягом 4 тижнів первинного або повторного інфаркту.
У своєму розвитку інфаркт міокарда проходить 3 стадії. 1) ішемічна стаді я тривалістю до 18 год відрізняється практично повною відсутністю макроскопічних змін в серці. До кінця терміну можна побачити нерівномірність кровонаповнення міокарда. Через 20-30 хв при електронній мікроскопії відзначають набухання мітохондрій, зменшення числа гранул глікогену, розрив сарколеми, набряк, дрібні крововиливи і вихід в міокард окремих нейтрофілів. У зоні ішемії зникають: глікоген, дихальні ферменти.
Велике значення для перебігу і прогнозу захворювання має стан навколишнього тканини.
Цю стадію називають гострої осередкової ішемічною дистрофією міокарда і розглядає як самостійну форму гострої ІХС. Тоді виділяють тільки дві наступні стадії.
некротична стадія характеризується видимим некрозом, що відзначається через 18-24 год від моменту початку ішемії. У міокарді є вогнище неправильної форми, жовтувато-білого кольору, в'ялої консистенції, оточений темно-червоним віночком (ішемічний інфаркт з геморагічним вінчиком). при мікроскопічному дослідженні серцевого м'яза виділяють три зони. 1) некротическую, 2) демаркаційну і 3) сохранного міокарда. зона некрозу представлена: кардіоміоцити з явищами каріолізис, плазмолізіса і плазморексіса, оточені демаркаційним запаленням, велике кількостей гіперемійованих судин, безліч поліморфноядерних нейтрофілів (лейкоцитарний вал). Лейкоцитарна інфільтрація особливо виражена на 2-3-й день від початку захворювання. У збереженому міокарді спостерігаються явища набряку. При трансмуральном інфаркті міокарда захворювання часто ускладнюється розвитком фібринозного перикардиту.
Стадія організації. З 3-го дня починається дезінтеграція загиблих м'язових клітин макрофагами, з'являються окремі фібробласти. До 7-го дня по краях некрозу формується грануляційна тканина з великою кількістю фібробластів, макрофагів. На 28-й день утворюється рубець (постінфарктний кардіосклероз).
Загальна летальність при інфаркті міокарда досягає 30-35%.
Причинами смерті є: гостра серцево-судинна недостатність, кардіогенний шок, фібриляція шлуночків, асистолія. В результаті розм'якшення серцевого м'яза в області трансмурального інфаркту (Міомаляція) можливий розвиток гострої аневризми серця з подальшим розривом. В цьому випадку смерть настає від тампонади порожнини перикарда.
У випадках гострої аневризми і при субендокардіальному локалізації некрозу може відбутися пошкодження ендокарда і освіту пристінкових тромбів. Вони можуть стати джерелом тромбоемболії
При трансмуральном інфаркті міокарда можливий розвиток фібринозного перикардиту, аритмій, набряку легенів. Болі можуть віддавати в черевну порожнину, Даючи картину "гострого живота" (Абдомінальна форма інфаркту міокарда). Можлива помилкова симптоматика гострого порушення мозкового кровообігу (Церебральна форма). У ряді випадків (у людей похилого віку, фізично сильних людей, Що зловживають алкоголем, хворих на цукровий діабет) відзначається безболевая форма інфаркту міокарда.
Хронічна ішемічна хвороба серця. Входять: 1) постінфарктний (великовогнищевий) кардіосклероз, 2) дифузний дрібновогнищевий (атеросклеротичний) кардіосклероз і 3) хронічна аневризма серця.
рубець виникає в результаті організації інфаркту, має вигляд білястого вогнища щільною консистенції, неправильної форми, оточеного гіпертрофованим міокардом (Компенсаторна постинфарктная гіпертрофія). При фарбуванні пикрофуксином по ван Гизону надає рубцевої тканини червоний, а збереженій м'язової - жовтий колір. Значне збільшення кардіоміоцитів спостерігається в периинфарктной зоні, що отримало назву регенераційної гіпертрофії.
При дифузному мелкоочаговом кардіосклероз на розрізі спостерігаються множинні дрібні до 1-2 мм осередки белесоватой сполучної тканини. У вінцевих артеріях серця відзначаються звужують просвіт фіброзні бляшки. Відзначаються атрофія і ліпофусциноз кардіоміоцитів.
Хронічна аневризма серця утворюється з розірвалася гострої або в результаті випинання постінфарктної рубцевої тканини під тиском крові. Найчастіше локалізується в передньо-боковій стінці лівого шлуночка і верхівки серця. Серце збільшене в розмірах, з вибухає истонченной в області аневризми стінкою лівого шлуночка, представленої фіброзної тканиною. В області аневризми спостерігають пристінкові тромби.
Хворі вмирають від хронічної серцево-судинної недостатності, що виникає при декомпенсації серця, тромбоемболічного синдрому.
Гіпертензивна (Гіпертензійного) хвороба серця - ураження серця внаслідок підвищення тиску крові в системі кровообігу. Виділяють левожелудочковую і правожелудочковую форми захворювання.
Системна (лівошлуночкова) гіпертензивна хвороба серця діагностується при наявності артеріальної гіпертензії і відсутності будь-яких інших захворювань серця (наприклад, вад серця, ІХС та ін.). Відзначається робоча гіпертрофія міокарда лівого шлуночка, товщина якого перевищує "нормальні" 1,2 см. Розвивається концентрическая, а потім ексцентрична гіпертрофія серця. при концентрической гіпертрофії еластична стінка лівого шлуночка потовщується. Зростає співвідношення товщини лівого шлуночка і радіусу його порожнини. Потім настає декомпенсація, лівошлуночковою недостатністю з розвитком набряку легенів, а в хронічних ситуаціях - бура індурація.
Легенева (правошлуночкова) гіпертензивна хвороба серця (Легеневе серце, cor pulmonale) може бути гострою і хронічною. Гостре легеневе серце розвивається при масивній тромбоемболії в систему легеневої артерії і проявляється гострою дилатацією правого шлуночка (а потім правого передсердя) та гострої правошлуночкової недостатністю.
Хронічне легеневе серце відрізняє робоча концентрическая гіпертрофія правого шлуночка (що досягає товщини 0,4-1,0 см проти 0,2 см в нормі) з подальшою його дилатацією.
Виникає при хронічних дифузних захворюваннях легенів, васкулітах, метастатических ураженнях легень, проявляється хронічною правошлуночкової недостатністю і венозним застоєм у великому колі кровообігу.
Судинна система функціонує як єдине ціле. Зростання навантаження в одному з кіл кровообігу неминуче призводить до відповідних змін і в іншому. Тому з часом розвивається тотальна (поєднана) серцева недостатність.
Ішемічна хвороба серця (ІХС) - група захворювань, обумовлених абсолютною або відносною недостатністю коронарного кровообігу. У переважній більшості випадків ІХС розвивається при атеросклерозі вінцевих (коронарних) артерій, тому є синонім назви - коронарна хвороба.
В якості самостійної групи хвороб ІХС була ви¬делена ВООЗ в 1965 році у зв'язку з великою соціальною значимістю. До 1965 року всі випадки ІХС описувалися як кардіальна форма атеросклерозу або гіпертонічної хвороби. Виділення ІХС в самостійну групу було продиктовано епідемічним зростанням захворюваності і смертності від його ускладнень і необхідністю термінової вироблення заходів боротьби з ними.
Схожі з ІХС зміни в міокарді набагато рідше розвиваються без атеросклерозу вінцевих артерій серця і обумовлені іншими хворобами, які ведуть до відносної або абсолютної недостатності вінцевого кровообігу: вроджені ано¬маліі вінцевих артерій, артеріїти, тромбоемболії вінцевих артерій при тромбендокардіта, порушення оксигенації крові при важких «цианотичних »пороках серця, анеміях, отравле¬ніях оксидом вуглецю (II) СО, легеневої недостатності та ін. Зміни міокарда при перерахованих захворюваннях не належать до ІБ , А розглядаються як ускладнення цих захворювань.
Епідеміологія. ІХС є основною причиною смерті в багатьох економічно розвинених країнах світу. У США, наприклад, щороку реєструються 5,4 млн нових хворих,] / 2 з яких инвалидизируются і 550 000 гинуть. З кінця 60-х років показники захворюваності ІХС чоловічого населення працездатного віку стали різко зростати, що змусило говорити про епідемію ІХС. В останніми роками у багатьох країнах намітилася тенденція до стабілізації рівнів захворюваності та смертності від ІХС, що зумовлена великою кількістю причин: забороною на куріння, зниженням вмісту холестерину в їжі, корекцією підвищеного артеріального тиску, хірургічним лікуванням і ін.
Етіологія і патогенез. ІХС має загальні етіологічні і патогенетичні чинники з атеросклерозом і гіпертонічною хворобою, що не випадково, так як ІХС фактично є кардіальної формою атеросклерозу і гіпертонічної хвороби.
Патогенетичні фактори ІХС називаються також факторами ризику, оскільки визначають ступінь ймовірності разві¬тія захворювання. За ступенем значущості їх підрозділяють на фактори першого і другого порядку. До найважливіших факторів ризику першого порядку відносяться: гіперліпідемія, тютюнопаління, артеріальна гіпертензія, знижена фізична активність, ожиріння, фактор харчування (холестеринових дієта), стрес, зниження толерантності до глюкози, чоловіча стать, вживання алкоголю. Серед факторів ризику другого порядку - порушення вмісту мікроелементів (цинк), підвищення жорсткості води, збільшення рівня кальцію і фібриногену в крові, гіперуріке-
Гіперліпідемія. Гіперхолестеринемія і гіпертригліцеридемія - найважливіші патогенетичні фактори у розвитку атеросклерозу вінцевих артерій серця. Встановлена пряма залежність між рівнем холестерину в крові і смертністю при ІХС. У людей з концентрацією холестерину менше 150 мг / л і відносно низьким рівнем ліпопротеїдів низької щільності (ЛПНЩ) ІХС розвивається відносно рідко. Самостійне значення гіпертригліцеридемії є спірним, однак показана кореляція між підвищенням в крові їх концентра¬ціі паралельно з ЛПНЩ. Стає зрозумілим часте разві¬тіе ІХС у хворих на цукровий діабет.
Тютюнопаління, ІХС у курців розвивається в 2,14 рази частіше, ніж у некурящих. Основний ефект куріння обумовлений стіму¬ляціей симпатичної частини автономної нервової системи, накопиченням оксиду вуглецю (11) в крові, імунними ушкодженнями судинної стінки і активацією агрегації тромбоцитів. У людей, що викурюють більше 25 сигарет в день, виявляється зниження рівня ліпопротеїдів високої щільності (ЛПВЩ) і підвищення рівня ліпопротеїдів дуже низької щільності (ЛПДНЩ). Ризик розвитку ІХС зростає зі збільшенням числа викурених сигарет.
Артеріальна гіпертензія. Ускладнює перебіг атеросклерозу, сприяє розвитку гіалінозу артеріол і викликає ги пертрофію міокарда лівого шлуночка. Всі ці фактори в з сукупності підсилюють ішемічні ушкодження в міокарді
Роль атеросклерозу вінцевих артерій. Більше 90% хворих на ІХС мають стенозирующий атеросклероз вінцевих артерій зі стенозом 75% хоча б однієї магістральної артерії. Результатом ти експериментальних і клінічних спостережень показують що 75% стеноз вінцевих артерій не може забезпечити потреб ності м'язи серця в кисні навіть при невеликому навантаженні Безпосередніми причинами ішемічних пошкодженні міокарда при ІХС є тромбоз вінцевих артерій, тром боемболія, тривалий спазм, функціональне перенапруження міокарда в умовах стенозирующего атеросклерозу вінцевих артерій і недостатнього колатерального кровообігу. Тромбоз вінцевих артерій виявляється в 90% випадків трансмурального інфаркту міокарда - однієї з найважчих форм ІХС. Тромб локалізується зазвичай в області виразок атеросклеротичної бляшки. Генез тромбу пов'язаний з агрегацією тромбоцитів в місці виразки бляшки, де відбувається оголення субендотеліального шару і вихід тканинного тромбопластину. У свою чергу агрегація тромбоцитів призводить до викиду ними агентів, що викликають вазоспазм, - тромбоксану А2, серотоніну, гістаміну та ін. Аспірин знижує синтез тромбоксану А2 і пригнічує агрегацію тромбоцитів і вазоспазм.
Тромбоемболія в вінцеві артерії зазвичай відбувається при відриві тромботичних мас з їх проксимальних відділів, а також з порожнини лівого шлуночка.
Тривалий спазм вінцевих артерій доведений ангіографічними даними. Спазм розвивається в магістральних стовбурах вінцевих артерій, уражених атеросклерозом. Механізм вазоспазма складний, обумовлений місцевим викидом вазоактивних речовин, що утворюються при агрегації тромбоцитів на поверхні атеросклеротичних бляшок. Після дозволу тривалого вазоспазму в міокарді відновлюється кровообіг, але це часто призводить до додаткових ушкоджень, пов'язаних з реперфузією, реперфузійного пошкодженням. Вазоспазм може також закінчуватися тромбозом вінцевої артерії. Механізм тромбозу може бути обумовлений пошкодженням атеросклеротичної бляшки під час спазму, що особливо часто відбувається при атерокальциноз.
Функціональне перенапруження в умовах недостатності колатерального кровообігу при атеросклерозі вінцевих артерій також може призводити до ішемічним ушкодженням міокарда. При цьому доведено значення ступеня стенозу і поширеності атеросклерозу. Значущим вважається стеноз більше 75% хоча б одного магістрального стовбура вінцевої артерії.
Морфогенез. При ІХС стадийно розвиваються ішемічні ушкодження міокарда та регенераційні процеси.
Механізм ішемічного пошкодження міокарда складний і
обумовлений припиненням надходження в міокардіоцити кисню, порушенням окисного фосфорилювання і, отже, виникненням дефіциту АТФ. В результаті порушується робота іонних помп, і в клітини надходить надмірна кількість натрію і води, в той же час відбувається втрата клітинами калію. Все це призводить до набряку і набухання мітохондрій
і самих клітин. У клітку надходить також надмірна кількість кальцію, що викликає активацію Са2 + -залежних протеаз
кальпаіна, дисоціацію актінових микрофиламентов. активацію фосфоліпази А2. В кардіоміоцитах посилюється гліколіз, розщеплюються запаси глікогену, що призводить до щідозу. В умовах дефіциту кисню утворюються активні форми кисню і пероксиди ліпідів. Потім настає руйнування мембранних структур, перш за все мітохондріальних, настають незворотні пошкодження.
Зазвичай ішемічні ушкодження міокарда йдуть по шляху коагуляції і апоптозу. При цьому активуються негайно реагують гени, перш за все c-fos, і включається програма «запрограмованої смерті» - апоптозу. Велике значення при цьому мають кальцієві механізми ушкодження. При апоптозу відзначається активація кальцієвих ендонуклеаз з гідролізом ДНК на одноцепочечниє фрагменти.
У периферичних зонах ішемічне пошкодження зазвичай закінчується колікваційним некрозом з набряком клітин і міоцітолізом, що особливо характерно для реперфузійного ушкоджень.
Ішемічні пошкодження міокарда можуть бути оборотними і необоротними.
Оборотні ішемічні ушкодження розвиваються в перші 20-30 хв ішемії і в разі припинення дії фактора, їх викликає, повністю зникають. Морфологічні зміни виявляються в основному при електронної мікроскопії (ЕМ) і гістохімічних дослідженнях. ЕМ дозволяє виявити набухання мітохондрій, деформацію їх крист, релаксацію міофібрил. Гістохімічно виявляються зниження активності дегідрогеназ, фосфорілази, зменшення запасів глікогену, внутрішньоклітинного калію і збільшення концентрації внутрішньоклітинних натрію і кальцію. Деякі автори відзначають, що при світловій мікроскопії виявляються хвилеподібні м'язові волокна на периферії зони ішемії.
Необоротні ішемічні ушкодження кардіоміоцитів починаються після ішемії тривалістю більше 20-30 хв. У перші 18 год морфологічні зміни реєструються тільки за допомогою ЕМ, гістохімічних і люмінесцентних методів. При ЕМ виявляються розриви сарколеми, відкладення аморфного матеріалу (кальцію) в мітохондріях, руйнування їх крист, конденсація хроматину і поява гетерохроматина. У стромі - набряк, повнокров'я, диапедез еритроцитів, крайове стояння поліморфноядерних лейкоцитів, які можна спостерігати також і при світловій мікроскопії.
Після 18-24 год ішемії формується зона некрозу, видима мікро- і макроскопічно, тобто формується інфаркт міокарда. При інфаркті міокарда розвиваються три види некрозу:
- коагуляційний - локалізується в центральній зоні, кар-діоміоціти витягнутої форми, характерні кариопикноз і на¬копленіе кальцію. Коагуляційний некроз фактично є проявом апоптозу; некротичні маси видаляються шляхом їх фагоцитозу макрофагами;
- коагуляційний з подальшим міоцітолізом - некроз м'язових пучків з явищами пересокращенія і коагуляційних-ного некрозу, а також накопиченням кальцію в клітинах, але з наступним лізисом некротичних мас. Даний некроз розташовується в периферичних відділах інфаркту і обумовлений дією ішемії і реперфузії;
- міоцітоліз - колліквационний некроз - набряк і разруше¬ніе мітохондрій, накопичення в клітині натрію і води, розвиток гидропической дистрофії. Некротичні маси елімінуються шляхом лізису і фагоцитозу.
Навколо зони некрозу формується зона демаркационного запалення, представлена в перші дні повнокровними судинами з діапедез еритроцитів і лейкоцитарною інфільтрацією. В подальшому відбувається зміна клітинних кооперацій, і в зоні запалення починають переважати макрофаги і фібробла-сти, а також новостворені судини. До 6-му тижні зона некрозу заміщається молодий сполучною тканиною. Після перенесеного інфаркту міокарда на місці колишнього некрозу формується вогнище склерозу. Хворий, який переніс гостру катастрофу, залишається з хронічним захворюванням серця у вигляді постінфарктного кардіосклерозу і стенозуючого атеросклерозу вінцевих артерій.
Класифікація. ІХС тече хвилеподібно, супроводжуючись коронарними кризами, тобто з епізодами гострої (абсолютної) і / або хронічної (відносної) коронарної недостатності. У зв'язку з цим виділяють гостру ІХС і хронічну ІХС. Гостра ІХС характеризується розвитком гострих ішемічних поврежде¬ній в міокарді, хронічна ішемічна хвороба серця - кардиосклерозом в результаті ішемічних ушкоджень.
Класифікація ІХС
ГОСТРА ІХС
1. Раптова серцева смерть
2. Гостра вогнищева ішемічна дистрофія міокарда
3. Інфаркт міокарда
Хронічна ішемічна хвороба серця
1. Великовогнищевий кардіосклероз
2. Дрібновогнищевий кардіосклероз
Гостру ІХС поділяють на три форми: раптова сердеч¬ная смерть, гостра вогнищева ішемічна дистрофія міокарда та інфаркт міокарда.
Хронічна ішемічна хвороба серця представлена постінфарктним крупно¬очаговим і дифузним дрібновогнищевим кардиосклерозом.
Раптова серцева смерть. У літературі раптова серцева смерть визначається як смерть, що розвинулася
миттєво або за лічені хвилини, кількох годин після виникнення симптомів ураження серця. У більшості випадків (до 80%) вона виникає у хворих на ІХС з атеросклерозом вінцевих артерій. Однак слід пам'ятати, що раптова серцева смерть може розвинутися і при інших захворюваннях.
Раптової серцевої смертю при гострій ІХС вважають смерть в перші 6 год гострої ішемії міокарда. У цей період у 74-80% хворих реєструються зміни зубців Q, Г, інтервалу S - Т, летальні аритмії (фібриляція шлуночків, асистолія) на ЕКГ, однак ферменти крові в цей часовий інтервал ще не змінюються.
Морфологічні зміни можуть відповідати ранніх стадій ішемічних ушкоджень на тлі незміненого міокарда, але частіше - на тлі кардіосклерозу або розвинувся раніше інфаркту міокарда. При цьому нерідко ушкодження локалізуються в області провідної системи, з чим і пов'язаний розвиток аритмій. В осередках гострих ішемічних ушкоджень, визвав¬шіх раптову смерть, макроскопічних змін не виявляється. Мікроскопічно можуть виявлятися хвилеподібно змінені м'язові волокна і початкові прояви коагулят-ційного некрозу в периферичних відділах. При ЕМ виявля¬ются пошкодження мітохондрій, відкладення в них кальцію, розриви сарколеми, маргінація хроматину, гистохимически -зниження активності дегідрогеназ, зникнення глікогену.
Гостра оклюзія вінцевих артерій тромбом або тромбоем болом виявляється тільки в 40-50% розтинів померлих від раптової серцевої смерті. Відносна низька частота тромбозу може бути пояснена розвиваються фибринолизом а також можливої роллю вазоспазма і функціонального пере напруги міокарда в умовах дефіциту коронарного крово- звернення в генезі раптової серцевої смерті.
Танатогенез (механізм вмирання) при раптової серцевої смерті обумовлений розвитком летальних аритмій.
Гостра вогнищева ішемічна дистрофія міокарда. Форма гострої ІХС, що розвивається в перші 6-18 год після початку гострої ішемії міокарда. На ЕКГ реєструється ються характерні зміни. У крові може виявлятися підвищення вмісту ферментів, що надійшли з пошкоджений ного міокарда - креатінінкінази м'язового типу і глютен ноксалоацетаттрансамінази. При ЕМ і за допомогою гістохі чеських реакцій реєструються ті ж зміни, що і при поза запной серцевої смерті, відповідні раннім ішеміче ським пошкоджень, але виражені в більшій мірі. Крім того, при ЕМ можна спостерігати явища апоптозу, крайового недо троянда в осередках пересокращенія м'язових волокон.
У секційного столу ранні ішемічні ушкодження діагностуються за допомогою теллурита калію і солей тетразолия, що не фарбувальних зону ішемії в зв'язку з відсутністю в ній кісло¬рода і падінням активності дегідрогеназ.
Інфаркт міокарда. Форма гострої ІХС, що характеризується розвитком ішемічного некрозу міокарда. Розвивається через 18 годин після початку ішемії, коли зона некрозу стає видимою мікро- і макроскопічно. Крім змін ЕКГ, для нього характерна ферментеміі.
Макроскопічно інфаркт неправильної форми, білий з геморагічним вінчиком. Мікроскопічно визначається зона некрозу, оточена зоною демаркаційної запалення, отде¬ляющая першу від збереженій тканини міокарда. У зоні некрозу визначаються коагуляційний некроз в центрі, коагуляційний міоцітоліз і колліквационний некроз по периферії.
Зона демаркационного запалення в перші дні інфаркту представлена лейкоцитарним валом і повнокровними судинами з діапедез, а з 7-10-го дня - молодий сполучної тка¬нью, поступово заміщає зону некрозу і дозріває. Рубцювання інфаркту відбувається до 6-му тижні.
У перебігу інфаркту виділяють дві стадії: некрозу і рубцювання.
Класифікація інфаркту міокарда
I. За часом виникнення
1. Первинний (вперше виник)
2. Рецидивуючий (розвивається протягом 6 тижнів після попереднього)
3. Повторний (який розвинувся більш ніж через 6 тижнів після попереднього)
II. за локалізацією
1. Передньої стінки лівого шлуночка і передніх відділів міжшлуночкової перегородки
2. Задній стінки лівого шлуночка
3. Бічний стінки лівого шлуночка
4. міжшлуночкової перегородки
5. Великий інфаркт
III. за поширеністю
1. субендокардіальний
2. інтрамуральне
3. субендокардіальний
4. Трансмуральний
Залежно від часу виникнення виділяють первинний інфаркт (вперше виник), рецидивний (развів¬шійся протягом 6 тижнів після попереднього), повторний (який розвинувся після 6 тижнів після попереднього). при рецидивуючому
інфаркті виявляються вогнища рубці інфаркту і свіжі фокуси некрозу. При повторному - старі постінфарктний рубці і вогнища некрозу.
За локалізацією виділяють інфаркт передньої стінки лівого шлуночка, верхівки і передніх відділів міжшлуночкової перегородки - 40-50% випадків, розвивається при обтурації, стенозі лівого низхідній артерії; задньої стінки лівого шлуночка - 30-40% випадків, при обтурації, стенозі правого вінцевої артерії; бічної стінки лівого шлуночка - 15-20% випадків, при обтурації, стенозі гілки лівої вінцевої артерії. Рідше розвивається ізольований інфаркт міжшлуночкової перегородки - 7-17% випадків, а також обширний інфаркт - при обтурації основного стовбура лівої вінцевої артерії.
За поширеністю виділяють субендокардіальний, інтрамуральний, субепікардіальний і трансмуральний інфарк¬ти. ЕКГ-діагностика дозволяє диференціювати субендокардіальний і трансмуральний інфаркт. Вважають, що трансмуральний інфаркт завжди починається з ушкодження субепікарді-альних відділів в силу особливостей їх кровопостачання. Субендокардіальний інфаркт часто не супроводжується тромбозом вінцевих судин. Вважають, що в таких випадках він розвивається в результаті вазоспазма, індукованого місцевими гуморальни¬мі факторами. Навпаки, при трансмуральном інфаркті в 90% випадків знаходять тромбоз вінцевих артерій серця. Трансмуральний інфаркт супроводжується розвитком пристінкового тромбозу і перикардиту.
Ускладнення інфаркту: кардіогенний шок, фібриляція шлуночків, асистолія, гостра серцева недостатність, міо-маляціі і розрив серця, гостра аневризма, пристінковий тромбоз з тромбоемболічними ускладненнями, перикардит.
Смертність при інфаркті міокарда становить 35% і розвивається найчастіше в ранній, доклінічних період хвороби від летальних аритмій, кардіогенного шоку і гострої серцевої недостатності. У більш пізній період - від тромбоемболії і розриву серця, нерідко в області гострої аневризми з тампонадою порожнини перикарда.
Великовогнищевий (постінфарктний) кардіосклероз. Розвивається в результаті перенесеного інфаркту та представлений фіброзної тканиною. Збережено міокард піддається регенераційній гіпертрофії. У разі, якщо великовогнищевий кардіосклероз виникає після трансмурального інфаркту міокарда, може розвинутися ускладнення - хронічна анев¬різма серця. Смерть настає від хронічної серцевої недостатності або тромбоемболічних ускладнень.
Дифузний дрібновогнищевий кардіосклероз. Як форма хронічної ІХС, дифузний дрібновогнищевий кардіосклероз розвивається внаслідок відносної коронарної недостатності з розвитком дрібних вогнищ ішемії. Може супроводжуватися атрофією і ліпофусцинозом кардіоміоцитів. Цереброваскулярні захворювання (виділені в самостійну групу - ВООЗ в 1977 р) характеризуються гострими на¬рушеніямі мозкового кровообігу, фоном для розвитку ко¬торих є атеросклероз і гіпертонічна хвороба. Хворі з цереброваскулярними захворюваннями складають більше 50% пацієнтів неврологічних стаціонарів.
Класифікація цереброваскулярних захворювань
I. Захворювання головного мозку з ішемічним пошкодженням
1. Ішемічна енцефалопатія
2. Ішемічний інфаркт головного мозку
3. Геморагічний інфаркт головного мозку
II. внутрішньочерепні крововиливи
1. Внутрішньомозкові
2. Субарахноїдальні
3. Змішані
III. Гіпертензійного цереброваскулярні захворювання
1. Лакунарні зміни
2. Субкортикальна лейкоенцефалопатія
3. Гіпертензійного енцефалопатія
Розрізняють такі основні групи захворювань: 1) захворювання головного мозку, пов'язані з ішемічними повреж¬деніямі - ішемічна енцефалопатія, ішемічний і геморагічний інфаркти головного мозку; 2) внутрішньочерепні крововиливи; 3) гіпертензійного цереброваскулярні заболева¬нія - лакунарні зміни, субкортикальная лейкоенцефалопатія, Гіпертензійного енцефалопатія.
У клініці використовується термін інсульт (від лат. In-sultare -скакать), або мозковий удар. Інсульт може бути представлений різноманітними патологічними процесами: - геморагічним інсультом - гематомою, геморагічним просочуванням, субарахноїдальним крововиливом; - ішемічний інсульт - ішемічний і геморагічний інфаркт.
Захворювання головного мозку, обумовлені ішемічним пошкодженням. Ішемічна енцефалопатія. Стено-зірующій атеросклероз церебральних артерій супроводжується порушеннями в підтримці постійного рівня кров'яного тиску в судинах головного мозку. Виникає хронічна іше-
мія. Найбільш чутливими до ішемії є нейрони, перш за все пірамідні клітини кори великого мозку і грушоподібні нейрони (клітини Пуркіньє) мозочка, а також нейрони зони Зіммера гіпокампу. У цих клітинах реєструються кальцієві пошкодження з розвитком коагуляційного некрозу і апоптозу. Механізм може бути обумовлений продукцією цими клітинами нейротрансмітерів (глютамат, аспартату), здатних викликати ацидоз і розкриття іонних каналів. Ішемія викликає також активацію генів c-fos в цих клітинах, що веде до апоптозу.
Морфологічно характерні ішемічні зміни нейронів - коагуляція і еозинофілія цитоплазми, пикноз ядер. На місці загиблих клітин розвивається глиоз. Процес зачіпає не всі клітини. При загибелі невеликих груп пірамідних клітин кори великого мозку говорять про ламинарном некрозі. Найбільш часто ішемічна енцефалопатія розвивається на кордоні басейнів передньої і среднемозговой артерій, де в силу особливостей ангіоархітектоніки є сприятливі умови для гіпоксії - слабке анастомозірованіе судин. Тут іноді виявляються вогнища коагуляційного некрозу, звані також зневоднених інфарктами. При тривалому існуванні ішемічної енцефалопатії виникає атрофія кори великого мозку. Може розвинутися коматозний стан з втратою коркових функцій.
Інфаркти головного мозку. Причини інфарктів головного мозку аналогічні таким при ІХС, але в деяких випадках ішемія може бути викликана здавленням судини виростами твердої мозкової оболонки при дислокації головного мозку, а також падінням системного АТ.
Ішемічний інфаркт головного мозку характеризується розвитком колликвационного некрозу неправильної форми ( «вогнище розм'якшення») - Макроскопически визначається тільки через 6-12 ч. Через 48-72 ч формується зона демаркационного запалення, а потім відбувається резорбція некротичних мас і утворюється кіста. У рідкісних випадках на місці некрозу невеликих розмірів розвивається гліальний рубчик.
Геморагічний інфаркт головного мозку частіше є результатом емболії артерій головного мозку, має корковую локалізацію. Геморагічний компонент розвивається за рахунок діапедезу в демаркаційної зоні і особливо виражений при антикоагулянтної терапії.
Внутрішньочерепні крововиливи. Підрозділяють на внутрішньомозкові (гіпертензійного), субарахноїдальні (аневрізматі-етичні), змішані (паренхіматозні і субарахноїдальні - артеріовенозні вади).
Внутрішньомозкові крововиливи. Розвиваються при розриві микроаневризм в місцях біфуркації внутрішньомозкових артерій у хворих на гіпертонічну хворобу (гематома), а також в результаті діапедезу (петехіальні крововиливи, геморагічне просочування). Крововиливи локалізуються найчастіше в підкоркових вузлах головного мозку і мозочку. В результаті формується кіста з іржавими стінками за рахунок отложе¬ній гемосидерина.
Субарахноїдальні крововиливи. Виникають за рахунок розриву аневризм великих церебральних судин не тільки атеросклеротичного, а й запального, вродженого і травматичного генезу.
Гіпертензійного цереброваскулярні захворювання. Розвиваються у людей, які страждають гіпертензією.
Лакунарні зміни. Представлені безліччю дрібних рожевих кіст в області підкіркових ядер.
Субкортикальна лейкоенцефалопатія. Со¬провождается субкортикальной втратою аксонів і розвитком демиелинизации з глиозом і артеріологіалінозом.
Гіпертензійного енцефалопатія. Виникає у хворих з злоякісної формою гіпертонічної хвороби і супроводжується розвитком фібриноїдного некрозу стінок судин, петехіальних крововиливів і набряку.
Ускладнення інсультів. Паралічі, набряк головного мозку, дислокація головного мозку з вклиненням, прорив крові в полос¬ті шлуночків мозку, що призводять до смерті.
Немає коментарів.
Будь ласка, залогіньтеся для додавання коментарів.
На правах рукопису
РЕЗНИК Олексій Геннадійович
МОРФОЛОГІЧНІ ПРОЯВИ
Раптова смерть ВІД ІШЕМІЧНОЇ ХВОРОБИ СЕРЦЯ
Санкт-Петербург 2004
Робота виконана в Державному освітньому установі додаткової професійної освіти «Санкт-Петербурзька медична академія післядипломної освіти Міністерства охорони здоров'я Російської Федерації».
Науковий керівник:
доктор медичних наук Іванов Ігор Миколайович
Офіційні опоненти:
Заслужений працівник Вищої школи РФ доктор медичних наук
професор Мішин Євген Степанович
кандидат медичних наук Сафран Олександр Євгенович
Провідна установа: Санкт-Петербурзький державний медичний університет ім. акад. І.П. Павлова
Захист дисертації відбудеться в годині на засіданні спеціалізованої
спеціалізованої вченої ради Д 215.002.02 в Військово-медичної академії ім. СМ. Кірова МО РФ за адресою: 194044, Санкт-Петербург, вул. Лебедєва, 6.
З дисертацією можна ознайомитися у фундаментальній бібліотеці Військово-медичної академії ім. СМ. Кірова.
Вчений секретар спеціалізованої вченої ради
Сидорин B.C.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми
Під раптовою смертю традиційно розуміють непередбачену, несподівану, швидко настала смерть від гострого, приховано протікав захворювання [Шестов Д.Б. Плавінскій СІ. 1996: Томілін В.В. Пашинян Г.А. 2001]. Випадки смерті від хронічних захворювань також відносять до категорії раптової смерті, якщо хворі протягом останнього місяця своєму житті не перебували на стаціонарному або амбулаторному лікуванні і вели звичний спосіб життя [Липовецький Б.М. 1992]. В даний час замість терміна раптова смерть вживається термін раптова смерть. Ці терміни слід розглядати як синоніми [Вітер В.І. Пермяков А.В. 2000; Томілін В.В. Пашинян Г.А. 2001].
Раптова смерть може настати від патології будь-якої системи організму, але найбільш частою її причиною є хвороби серцево-судинної системи - Ішем !! чна хвороба серця, гіпертонічна хвороба, атеросклероз. Провідне місце в цьому списку займає ішемічна хвороба серця, на частку якої припадає 75% від загального числа хвороб серцево-судинної системи [Мальцев СВ. 1997; Бойко Ю.А. 2000; Томілін В.В. Пашинян ГА. 2001].
Особливістю раптової смерті при ішемічній хворобі серця є те, що 30-40% від загального числа померлих гинуть в перші десятки хвилин від початку захворювання і приблизно стільки ж у подальше 2 години. Навіть при добре організованій екстреної медичної допомоги 2/3 смертей відбувається на догоспітальному етапі [Вітер В.І. Пермяков А.В. 2000; Кириченко А.А. 2002; Goldstein J.A. 2000; Libby P. 2001]. Наступаючи несподівано, вона викликає підозру на насильство і тому є предметом судово-медичного дослідження [Мальцев СВ. 1997; Новосьолов В.П. Савченко СВ. 1997; Бойко Ю.А. 2000].
Специфікою судово-медичного дослідження трупів осіб, померлих раптово, є відсутність медичної документації, тому встановлення причини смергі і судово-медичний діагноз грунтується тільки на морфологічних даних. Однак, через те, що летальний результат наступає дуже швидко, макроскопічні зміни в 50% випадків в міокарді відсутні, а патофізіологічні механізми раптової смерті-розкриті не до кінця. Тому основною проблемою є з'ясування танатогенетіческой ролі ішемії міокарда при ішемічній хворобі серця [Непомнящий Л.М. 1996; Чазов Є.І. 1997; Томілін В.В.,
Таким чином, діагностика раптової смерті від гострих форм ішемічної хвороби серця в судово-медичній практиці зберігає свою актуальність до теперішнього часу.
Пашинян ГА. 2001; Cina S.J. et al. 1998; Haider K.H. 1999; Ooi D.S. et al. 2000].
Мета дослідження
Метою роботи є встановлення інформаційно-значущих морфологічних ознак раптової смерті від гострих форм ішемічної хвороби серця на основі комплексного макро- і мікроскопічного, біохімічного дослідження серця.
Завдання дослідження
Основними завданнями дослідження були:
1. На основі уніфікованого забору матеріалу для гістологічного дослідження встановити топографічні особливості поширення ішемічного пошкодження лівого шлуночка серця при гострих формах ішемічної хвороби серця.
2. За допомогою світлової та поляризаційної мікроскопії виявити інформаційно-значимі морфологічні ознаки гострих форм ішемічної хвороби серця.
3. Оцінити можливості комп'ютерної обробки зображення мікропрепаратів серця з подальшим морфометричних дослідженням для діагностики гострих форм ішемічної хвороби серця.
4. Простежити взаємозв'язок між макроскопічними і мікроскопічними змінами серця.
5. Встановити взаємозв'язок між морфологічними змінами в міокарді і біохімічними показниками перикардіальної рідини при раптової смерті від гострих форм ішемічної хвороби серця.
Наукова новизна.
Вперше на основі уніфікованого забору матеріалу і комплексного мікроскопічного дослідження, що включає світлову і поляризаційну мікроскопію, виявлені особливості поширення ішемічного процесу в лівому шлуночку серця при гострих формах ішемічної хвороби серця. Розроблено інформаційно-морфологічні критерії, що дозволяють діагностувати гострі форми ішемічної хвороби - гостру коронарну недостатність і гострий інфаркт міокарда в донекротіческой стадії - і проводити між ними диференціальну діагностику. Показана можливість комп'ютерної обробки зображення мікропрепаратів серця з подальшим морфометричних дослідженням для діагностики гострих форм ішемічної хвороби серця. Отримано нові дані, що показують, що поряд з поляризационной мікроскопією, забарвлення мікропрепаратів хромотропом 2В водним блакитним дозволяє виявити гострі пошкодження кардіоміоцитів. Простежено взаємозв'язок між ступенем стенозування коронарних артерій і мікроскопічними змінами в міокарді лівого шлуночка, відзначені відмінності в перебудові артеріальної системи серця у чоловіків і жінок. Встановлено взаємозв'язок між мікроскопічними змінами в лівому шлуночку серця і серцевими маркерами в перикардіальної рідини.
Практична значимість
Проведене дослідження показало, що при смерті від гострої коронарної недостатності втрата скоротливої здатності міокарда
лівого шлуночка настає одночасно в трьох і більше топографічних областях. При смерті від гострого інфаркту міокарда в донекротіческой стадії втрата скоротливої здатності міокарда відбувається в одній-двох топографічних областях. Отримані дані дозволили. запропонувати комплекс диференційно-діагностичних критеріїв для верифікації гострих форм ішемічної хвороби серця, заснований на уніфікованому заборі матеріалу для гістологічного дослідження, світлової та поляризаційної мікроскопії, комп'ютерної обробки зображення мікропрепаратів з подальшою морфометрії. Виявлені нові діагностичні можливості забарвлення гістологічних препаратів хромотропом 2В водним блакитним. Підтверджено значення серцевих маркерів перикардіальної рідини в плані діагностики гострих форм ішемічної хвороби серця.
Результати дослідження впроваджені в практику роботи Волгоградського і Новгородського обласних бюро судово-медичної експертизи, Волгоградського обласного патологоанатомічного бюро, а також в навчальний процес кафедр судової медицини Санкт-Петербурзької медичної академії післядипломної освіти МОЗ РФ і Волгоградського Державного медичного університету, кафедри патологічної анатомії Волгоградського Державного медичного університету.
Основні положення, що виносяться на захист
На захист виносяться такі основні положення:
1. Значення уніфікованого забору матеріалу для гістологічного дослідження при підозрі на смерть від гострих форм ішемічної хвороби серця.
2. Інформаційно значущі морфологічні ознаки, які виявляються за допомогою світлової та поляризаційної мікроскопії.
3. Взаємозв'язок макроскопічних і мікроскопічних змін в серці при гострих формах ішемічної хвороби серця.
4. Діагностичне значення серцевих маркерів перикардіальної рідини у випадках смерті від гострих форм ішемічної хвороби серця.
Апробація роботи
Матеріали дисертації неодноразово обговорювали на засіданнях кафедр судової медицини та патологічної анатомії Санкт-Петербурзької медичної академії післядипломної освіти МОЗ РФ і Волгоградського Державного медичного університету. Результати наукової роботи були повідомлені на засіданні Петербурзького наукового товариства судових медиків (2003).
Апробація роботи здійснена на спільному засіданні кафедр судової медицини Санкт-Петербурзьких медичних академій післядипломної освіти та державної медичної академії ім. І.І. Мечникова 17 листопада 200З року.
Структура і обьеч дисертації
Дисертація викладена на 127 сторінках машинописного тексту. Складається зі вступу, 4-х розділів, висновків, практичних рекомендації, Списку використаних джерел, що включає 144 вітчизняних і 101 зарубіжний джерело. Робота ілюстрована 32 таблицями, 18 рисунками.
Матеріали і методи дослідження
Матеріалом цієї роботи послужили 47 випадків раптової смерті на грунті гострих форм ішемічної хвороби серця - гострої коронарної недостатності (38) і гострого інфаркту міокарда в донекротіческой стадії (9). Серед померлих було 36 чоловіків і 11 жінок, середній вік яких склав 50,6 ± 1,4 років. У 19 померлих (40%) в крові виявлений етиловий спирт в концентрації менше 3% о. При наборі матеріалу враховувалося відсутність різних захворювань, травматичних ушкоджень, ознак отруєння етиловим алкоголем, отруйними, сильнодіючими та іншими речовинами, які могли послужити причиною смерті. Особлива увага приділялася диференціальної діагностики алкогольної кардіоміопатії.
В якості контролю використаний матеріал від 45 трупів людей, які загинули на догоспітальному етапі від черепно-мозкової травми (21) та від механічної асфіксії при повішення (24). Вибір контролю був заснований па тому, що причина смерті при черепно-мозковій травмі обумовлена розладом функції головного мозку, а при механічної асфіксії -розлади функції головного мозку і дихання. У контрольній групі було 34 чоловіки і 11 жінок у віці 47,5 ± 1,1 років (р\u003e 0,05). У 31 загиблого (69%) в крові виявлений етиловий спирт в концентрації до 3% ©.
Дослідження трупів основної та контрольної груп проводилося протягом 24 годин після смерті. При макроскопічному дослідженні реєстрували основні параметри серця: масу, розміри, товщину стінки лівого і правого шлуночків. Ступінь ураження вінцевих артерій атеросклерозом оцінювали візуально-планіметрична методом [Лвтанділов Г.Г. 1970, 1990]. Для судово-гістологічсского дослідження за уніфікованою методикою вирізали п'ять шматочків серця по колу, що проходить через середину відстані між верхівкою і мітральним клапаном з міжшлуночкової перегородки, передньої, бічної і задньої стінок лівого шлуночка, а також з верхівки [Мазурснко М.Д. Зіміна Ю.В. 1998].
Мікроскопічного дослідження в цілому були повалені 1380 гістологічних препаратів - нативних і забарвлених гематоксиліном і еозином, а також хромотропом 2В водним блакитним. У їх числі 150 препаратів забарвлених гематоксиліном і еозином були вивчені після комп'ютерної обробки із застосуванням морфометрії. Крім того, 460 нативних препаратів були досліджені за допомогою поляризаційної мікроскопії. Мікроскопію препаратів проводили за допомогою мікроскопа «Биолам Р-15», «Биолам І» (окуляр 7 об'єктиви від 8х до 40х), для поляризаційної мікроскопії використовували поляризаційні фільтри, що входять до
стандартний набір до мікроскопа. Для тканинного морфометрического дослідження використовували комп'ютерну систему обробки зображень з програмним забезпеченням «ВідеоТсст-Морфо» (версія 3.2 Copyright «С» Санкт-Петербург, 1996).
При описі макро - і мікроскопічних даних серця використовували єдиний алгоритм для основної та контрольної групи, складений відповідно до цілей і завдань даного дослідження. Результати дослідження по кожному спостереженню систематизували в робочій карті, дані робочої карти вводили в електронні таблиці.
Додатково спільно з здобувачем кафедри судової медицини Санкт-Петербурзької медичної академії післядипломної освіти Н.В. Дзик проведено дослідження перикардіальної рідини. Було отримано 28 проб перикардіальної рідини у 20 трупів основної групи і 8 трупів контрольної групи. Кожна проба була досліджена за 6 показниками з метою визначення активності серцевих маркерів - креатинкінази (КК), серцевого ізоферменту креатинкінази (КК-МВ), лактатдегідрогенази (ДДГ), аснартатамінотрансферрази (АСТ), міоглобіну, серцевого тропоніну I (cTnl). Біохімічне дослідження показників перикардіальної рідини визначали методами, прийнятими в клінічній лабораторно-діагностичної практиці за допомогою стандартних наборів реактивів.
Також оцінці були піддані 741 випадок з архіву Волзького районного судово-медичного відділення Волгофадского обласного бюро судово-медичної експертизи за 2000 рік.
Обробка результатів дослідження проведена за допомогою персонального комп'ютера з процесором Intel Celeron 600 за загальноприйнятими для медико-біологічних досліджень методів за допомогою комп'ютерних програмних пакетів EXEL 5.0 (Office 2000, Professional), STATISTICA 6.0.
Статистичний і математичний аналіз мікроскопічних даних проводили відповідно до рекомендацій А.А. Генкина (1997, 1999) і Е.В. Гублсра (1973, 1990) з використанням кутового перетворення Фішера і аргументу нормального розподілу з подальшим математичним аналізом по Байеса, Вальдо і Кульбаку. В цілому було проаналтіровано 114 мікроскопічних ознак, по кожному го них був отриманий діагностичний бал (ДБ), інформаційний індекс (I), а також розрахований діагностичний поріг (ДП) для гострих форм ішемічної хвороби серця. Для встановлення взаємозв'язку між макроскопічними і мікроскопічними змінами в міокарді, а також між підлогою та мікроскопічними змінами в міокарді проведено додатковий статистичний і математичний аналіз наявного матеріалу, з використанням відсотка позитивних значень досліджуваного ознаки, виражений в частках одиниці (Р) [Гублср Є.В. 1973 1990; Гснкін А.А. 1 997, 1999J.
ОСНОВНІ РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ II ЇХ ОБГОВОРЕННЯ
Вивчення архівного матеріалу Волзького районного судово-медичного відділення Волгоградського обласного бюро судово-медичної експертизи показало, що в 2000 році від обшсго кількості розтинів (1506) випадки ненасильницьку смерть склали 49%, а захворювань органів кровообігу - 39%. Серед померлих від захворювань органів кровообігу частка ішемічної хвороби серця досягала 80%. в їх числі було 337 (72%) чоловіків і 134 (28%) жінки. Вік померлих варіював від 21 до 88 років, при цьому середній вік чоловіків був 58,3 ± 0,6 років, а жінок 65,5 ± 1,3 років (р<0,001). Таким образом, при скоропостижной смерти от ишемической болезни сердца мужчины умирали в 3 - 3,5 раза чаще, чем женщины. Полученные данные соглас>ються з загальноросійськими показниками.
Аналіз макроскопічних даних власного матеріалу показав, що обидві групи статистично значимо різняться тільки за одним показником товщина стінки лівого шлуночка. Так в нормі товщина стінки лівого шлуночка 1,1 - 1,4 см. Серед померлих від гострих форм ішемічної хвороби серця вона досягала 1,5 ± 0,1 см, а в контрольній групі 1,3 ± О, О4 см (р<0.05). что указывает на незначительную гипертрофию левого желудочка в основной группе наблюдений.
Інші показники були в межах норми. Так середні розміри серця в основній групі склали 11,8х11,0х5,4 см, а в контрольній 11,5х10,5х5,2 см (р\u003e 0,05). Товщина стінки правого шлуночка в кожній з груп була подібною -по 0,3 ± 0,01 см (р\u003e 0,05). В основній групі спостережень маса серця була в середньому 355,0 ± 10,2 г, що дещо перевищувало показник контрольної групи, де він був 332,9 ± 2,8 м Проте зазначене розходження було статистично достовірно (р\u003e 0,05 ).
Візуально-планіметрична оцінка змін коронарних артерій серця показала, що в основній групі ураження їх атеросклеротичним процесом мало місце у всіх без винятку випадках. При цьому в кожному третьому випадку (15 з 47) поширення атеросклеретіческіе процесу займало до 50% і більше площі судин. У кожному п'ятому спостереженні (8 з 47) атеросклеротичні бляшки перебували в стадії атероматоза і кальциноза.
У контрольній групі атеросклеротичнеураження коронарних артерій було відзначено менш ніж у половини померлих (19 з 45). При цьому у більшості ГО НИХ мали місце лише початкові прояви атеросклерозу, головним чином у вигляді поодиноких ліпоїдних плям.
Крім того, в основній групі важка ступінь стенозу коронарних артерій (понад 50% просвіту) була помічена в кожному четвертому випадку (в 12 з 47), в той час як в контрольній групі подібний стеноз зустрівся лише в двох спостереженнях.
Візуальна оцінка серця показала, що в основній групі найбільш часто зазначалося наявність дрібно- та крупноочаговом рубцевої тканини (в 26
спостереженнях), нерівномірне повнокров'я міокарда (в 23 спостереженнях) і в'ялість міокарда (в 12 спостереженнях).
На противагу цьому в контрольній групі практично завжди переважало рівномірний повнокров'я, а наявність рубцевої тканини в міокарді було відзначено тільки в кожному четвертому спостереженні. Особливістю контрольної групи було розширення правих відділів серця, яке зустрічалося виключно у померлих від механічної асфіксії.
Таким чином, отримані результати дослідження, - дозволяють зробити висновок, що в осіб, які померли раптово від гострих форм ішемічної хвороби не завжди можна виявити достовірні макроскопічні зміни в серці. Тому мікроскопічне дослідження серця, особливо у випадках гострих форм ішемічної хвороби, може мати вирішальне значення.
Математична обробка даних світлової мікроскопії препаратів, пофарбованих гематоксиліном і еозином, хромотропом 2В водним блакитним, а також поляризационной мікроскопії нативних препаратів дозволила розділити вивчені нами мікроскопічні ознаки на патогномонічні, диференційно-діагностичні та малоінформативні. Патогномонічні ознаки були присутні тільки в основній групі. Диференційно-діагностичні ознаки дозволяли диференціювати зміни при гострих формах ішемічної хвороби серця від контролю. Малоінформативні ознаки однаково часто зустрічалися як в основний, так і в контрольній групах і не мали діагностичного значення. Кожна ознака був оцінений в балах (ДБ), за якими був розрахований інформаційний індекс (I), а також розрахований діагностичний поріг (ДП) для гострих форм ішемічної хвороби серця, рівний більш +15 балів.
Математичний аналіз показав, що з 114 вивчених нами мікроскопічних ознак патогномонічними для гострих форм ішемічної хвороби серця є тільки три - контрактурной пошкодження кардіоміоцитів 3 ступеня, первинний глибчатий розпад міофібрил і внутрішньоклітинний міоцітоліз (див. Таблицю 1).
Було відзначено, що контрактурной пошкодження кардіоміоцитів 3 ступеня відзначалися у всіх випадках смерті від гострої коронарної недостатності. У той же час первинний глибчатий розпад міофібрил або внутрішньоклітинний міоцітоліз зустрічалися в одиничних спостереженнях. У випадках смерті від гострих інфарктів міокарда в донекротіческой стадії у всіх спостереженнях зазначалося поєднання всіх трьох зазначених патогномонічних ознак.
У контрольній групі у померлих від механічної асфіксії при повішення, була присутня своя «полярюаціонная картина», яка характеризувалася вогнищевими і поширеними субсегментарного контрактурами і сегментарними контрактурами 1 ступеня. Подібну картину ряд авторів характеризує як осередкові метаболічні ушкодження міокарда | Автандилов Г.Г. 1978: Целлариуса Ю.Г. і співавт. 1979; Непомнящий Л.М. 1996]. На нашу думку, при механічної асфіксії відбувається токсичне накопичення вуглекислоти в організмі, зміна газового
стану крові, порушення окислювальних процесів і електролітного балансу органів і тканин, розвиток ацидозу, що зумовило «поляризаційну картину» в контрольній групі.
Таблиця 1
Диференційно-діагностичні та патогномонічні морфологічні «поставлення кардіоміоцитів
Оцінювані ознаки Діагностичний бал (ДБ) Інформаційний індекс (1)
Рівномірний розташування анізотропних дісков.о «; у 1.10
Вогнищеві субсегментарние контрактури -6.6 4,10
Поширені субсегмеітарние контрактури -9.6 2,22
Контрактури 1ст. -4.2 1.37
Контрактури 2ст. 4.9 2.83
Контрактури Зет. -
Внутрішньоклітинний міоіітоліз -
Первинний глибчатий розпад міофібрил
* Патогномонічний ознака
Проведене дослідження дозволило виділити 41 діффереіціально-діапюстіческій ознака. Всі вони були згруповані в три групи -морфофункціональние зміни артерій, морфологічні зміни кардіоміоцитів, порушення реологічних властивостей крові та морфологічні зміни проміжній тканині.
Зміни артерій складаються з наявності в них склеротичного процесу, спазму і плазматичного просочування стінки, які в кінцевому підсумку призводять до звуження просвіту артерії. При цьому нами було помічено, що в інтрамуральних артеріях відбуваються більш виражені морфологічні зміни з переважанням спазму, плазматичного просякання стінки артерії, гіперхромною забарвлення ядер ендотелію (див. Таблицю 2).
Проведений математичний аналіз випадків основної групи показав, що при стенозі коронарних артерій більше 50% просвіту судини в інтрамуральних артеріях в 1,2 рази частіше відзначалося наявність спазму (відповідно Р = 0,78 і Р = 0,65; р<0.05). Обращает на себя внимание, что при стенозе коронарных артерий более 50% просвета сосуда мелкоочаговое разрастание соединительной ткани в межмышечном пространстве (Р=0,55 и Р=0,39) и межмышечный огек в 1,4 раза встречаются чаще
(р<0.05). В противоположность этим данным волнообразная деформация кардномиоцитов (Р=0.66 и Р=0,85: р<0.05) была характерна для легкой степени стеноза коронарных артерий. Наличие и характер острых повреждений
Таблиця 2
Диференційно-діагностичні морфологічні зміни артерій
¡Оцінювані ознаки Діагностіче- інформа-
ський бал (ДБ) ний індекс (I)
Коронарні артерії:
Спазм 4,4 1,16
Дистонія -5,4 2,91
Гіперхромні забарвлення ядер ендотелію 2.6 0,50
Іітрамуральние артерії:
Спазм 5,5 2,67
Дистонія -8,5 7.76
Наявність склеротичного процесу в
стінки судини. 2.7 0,50
плазматичне просочування
стінки артерії 4,1 1,63
Гіперхромні забарвлення ядер ендотелію 4,7 0.95
карліоміоцітов, а також глибина поширення ішемічного процесу в стінці міокарда від ступеня атеросклеротичного стенозу коронарних артерійне залежали.
У чоловіків в 1,2 рази частіше відзначався спазм коронарних артерій (Р = 0,85 і Р = 0,69; р<0,05), интрамуральных артерий (Р=0,68 и Р=0,55; р<0,05) и артериол (Р=0,65 и Р=0,54; р<0,05). При этом отмечено, что гиперхромная окраска ядер эндотелия коронарных артерий в 1,9 раза чаще встречалась у мужчин, чем у женщин (Р=0,60 и Р=0,31; р<0,001). Достоверных различий в гиперхромной окраске ядер эндотелия интрамуральных артерий не установлено. В противоположность этим данным для женщин было характерно плазматическое пропитывание стенки коронарных артерий (Р=0,94 и Р=0,78; р<0,05). Наличие и характер острых повреждений кардиомиоцитов, а также глубина распространения ишемического процесса в стенке миокарда не зависит от пола.
Таким чином, у чоловіків, які померли раптово від гострих форм ішемічної хвороби серця, має місце індивідуальна перебудова артеріальної системи серця у вигляді спазму коронарних і інтрамуральних артерій, артеріол і гіперхромною забарвлення ядер ендотелію коронарних артерій.
Отриманий результат підтверджує висловлювання ряду авторів про порушення регуляції тонусу артерій - функціонального спазму і функціонального стану ендотелію при гострих формах ішемічної хвороби серця [Бувальцев В.І. 2001: Чернов С.Л. 2002: Додати Libby P. 2001: J.C. 2002]
Для ідентифікації порушень функціонального стану ендотелію необхідно подальше дослідження з використанням гістохімічних, иммуноморфологических і електронно-мікроскопічних методів.
Морфологічні зміни кардіоміоцитів у осіб, померлих раптово від гострих форм ішемічної хвороби серця були представлені гіпертрофією з гіперхромією ядер, хвилеподібною деформацією, фрагментацією м'язових волокон (див. Таблицю 3). З усіх оцінюваних морфологічних змін кардіоміоцитів, у чоловіків статистично достовірно більше відкладення ліпофусцину в м'язових волокнах у порівнянні з жінками (Р = 0,87 і Р = 0,64; р<0,01).
Таблиця 3
Диференційно-діагностичні морфологічні зміни
кардіоміоцитів
Оцінювані ознаки Діагностичний бал (ДБ) Інформаційний індекс (I)
Гіпертрофія 3.2 1,52
Атрофія -7,2 4.61
Хвилеподібна деформація 2.5 0,50
Фрагментація 3.0 0,50
Відкладення ліпофусцину 2,6 1,34
Збільшення ядер 5,4 2,12
Гіперхромія ядер 5,1 1,88
Слабо помітна сарколеммой 12,0 7.20
Обумовлена при світловій мікроскопії забарвлених препаратів слабо помітна "сарколеммой, (що має діагностичний бал 12.0 і інформаційний індекс 7.2) говорить про неоднорідність цього диференційно-діагностичної ознаки. Поглиблений аналіз матеріалу показав, що поява цієї ознаки, як правило, поєднувалося одночасно з міжм'язові набряком, а при поляризаційної мікроскопії - з контрактурной ушкодженнями кардіоміоцитів 3 ступеня. Це вказує на підвищену проникність сарколеми кардіоміоцитів. на підвищення проникними ості сарколеми кардіоміоцитів при ішемії міокарда вказував П.Н.Ескунов (1993).
При раптової смерті від гострих форм ішемічної хвороби серця відбувається порушення реологічних властивостей крові з утворенням «плазматичних, судин» і плазматичним просочуванням капілярів, периваскулярного і міжм'язового набряку (див. Таблицю 4). У вивченому матеріалі венозне повнокров'я отримало однакову інформаційну оцінку в основній і контрольній групах. Цей момент можна пояснити тим. що настання смерті від гострих форм ішемічної хвороби і механічної асфіксії супроводжується венозним полнокровием.
Таблиця 4
Загальна характеристика венозного і мікроциркуляторного русла
бал (ДБ) ний
ІНЛЕКС (1)
Помірне кровонаповнення -3,4 0,30
Повнокров'я з явищами стазу крові 1.0 0,10
Спазм 4,9 2,14
Плазматичне просочування 4.5 0,78
капіляри:
Помірне кровонаповнення -6,0 0,70
Повнокров'я з явищами стазу крові -1,1 0,10
Плазматичне просочування з, з 0,50
«Плазматические судини» 5,1 2.35
Периваскулярний набряк 2,6 0,70
Міжм'язової набряк 4,9 2,71
Оцінка стану проміжній тканині показала, що при гострих формах ішемічної хвороби серця є розростання сполучної тканини периваскулярно і в міжм'язової просторі. Жодного значення жирової тканини для діагностики ішемічної хвороби серця, нами встановлено не було (див. Таблицю 5).
Оцінювані ознаки Діагностичний інформа-
- звичайна товщина -5,8 2,89
- периваскулярное розростання 3,2 1.32
- мелкоочаговое міжм'язової
розростання 3.7 0,93
- крупноочаговом міжм'язової
розростання 6.7 1,02
Жирова тканина:
- периваскулярное розростання -5.2 1.53
- межмишечнос розростання -6.3 2.20
Порівняльна оцінка гострих ушкоджень кардна іоцітов в препаратах, забарвлених хромотропом 2В водним блакитним і даних поляризационной мікроскопії, дозволила вивіть особливості накопичення
барвника - хромотропом 2В водного блакитного в цитоплазмі кардіоміоцитів в області гострих ушкоджень (див. таблицю 6).
Таблиця 6
Особливості накопичення хромотропом 2В водного блакитного при гострих
мікроскопічні | Поляризаційна ознаки. "Мікроскопія хромотропом 2В водний блакитний
Субсегментарние контрактури Скорочення окремих груп саркомерів при збереженої нормальної смугастість нескорочених ділянок міофібрил вогнища ацидофілія, перифокально рівномірне фарбування цитоплазми
Контрактури 1-2 ступеня Зближення світлих А-дисків за рахунок стоншування темних ізотропних I-дисків Ділянки підвищеної ацидофілія саркоплазмою, поперечна смугастість збережена
Контрактури 3 ступеня Ізотропні диски повністю зникають, анізотропні зливаються в суцільний ■ світиться конгломерат Масивні зони ацидофілія саркоплазмою, поперечна смугастість відсутня
Внутрішньоклітинний міоцітоліз Розчинення міофібрил на деякому протязі клітини, прилеглі ділянки зберігають нормальну смугастість: поляризационная картина «вид тканини, поїденою міллю» Гіпохромні ділянки саркоплазми, перифокально поперечнасмугастість збережена, зони ацидофілія
Глибчатий розпад міофібрил Множинні грудочки анизотропной субстанції, хаотично чергуються з ділянками позбавленими анізотропних структур На тлі гипохромии саркоплазми відзначаються різко ацидофільні грудочки.
Нами відмічено, що в області контрактурних змін відбувається дифузне накопичення, а в області внутрішньоклітинного міоцітоліза вимивання хромотропом 2В водного блакитного. У той же час в області глибчатого розпаду міофібрил на тлі гипохромии цитоплазми відзначаються поодинокі різко ацидофільні грудочки. Очевидно, що дані зміни в накопичення барвника відбуваються одночасно з гострими ушкодженнями кардіоміоцитів, які виявляються методом поляризаційної мікроскопії. Зазначені особливості говорять про переваги забарвлення хромотропом 2В
водним блакитним в порівнянні з забарвленням по Лі (ГОФПК). яка дозволяє виявити зміни в карліоміоіітах лише через 5-6 годин від початку фатального нападу [Сєров С.Ф. 1984; Забусов Ю.Г. з співавт. 2000].
Морфометричне дослідження, було виконано після комп'ютерної обробки зображення гістологічних препаратів, забарвлених гематоксиліном і еозином. У холі обробки зображення за допомогою спеціальних фільтрів домагалися виділення ядер із загального фону зображення препарату, потім здійснювали їх контрастування і підвищення чіткості контурів. Покращене зображення ядер піддавалося програмного морфометричні дослідження.
В ході морфометрії оцінювали плошадь ядра, відсоток площі ядра в клітині, об'ємну частку ядра в клітині, питома кількість ядер в зрізі, питому поверхню в зрізі, середню хорду і відстань між ядрами (див. Таблицю 7). Крім того, використовуючи інший набір фільтрів, окремо виділяли і покращували зображення цитоплазми і контурів кардіоміоцитів, що дозволяло провести морфометрію і оцінити товщину кардіоміоцитів і міжм'язової відстань (міжм'язової набряк). Були виявлені достовірні відмінності по товщині кардіоміоцитів, площі ядер м'язових волокон (рис. 1-2), міжм'язові відстаням (міжм'язові набряку) між основною і контрольною групою.
Таблиця 7
Результати морфометричного дослідження
Параметри Основна група Контрольна група
Середня площа ядра, ткггг 35,58 ± 0.87 ** 21.08 ± 0,52
Відсоток площі ядра 4.3 ± 0,44 ** 1,31 ± 0,27
Об'ємна частка ядра в клітині 0.04 ± 0.004 ** 0,01 ± 0,003
Площа поверхні ядра 0.04 ± 0.004 ** 0,02 ± 0.003
Питома кількість ядер в зрізі 0.00! ± 0.0001 0.005 ± 0,0001
Середня хорда. шкш 4.29 ± 0.14 ** 3.2 ± 0,06
Середня відстань між ядрами, шкш 119.46 ± 16.72 ** 422,78 ± 65,34
Середня товщина кардиомиоцита. шкш 24.06 ± 0.32 * 22.90 ± 0,41
Міжм'язової відстань (міжм'язової набряк), шкш 4.06 ± 0.1 ** 1,11 ± 0,02
* - р<0,05 **-р<0.001
Зіставлення результатів отриманих при мікроморфометріі з даними макроскопічних показників серця дозволяє вважати, що незначне збільшення маси серця у осіб. раптово померлих від гострих форм ішемнческой хвороби серця, в порівнянні з контрольною групою (відповідно 355.0 ± 10,2 г і 332,9 ± 2,8 г, р\u003e 0,05) може бути пояснено розвитком міжм'язового набряку (відповідно 4,06 ± 0, 1 шкш. і 1.11 ± 0.02 шкш: р<0.00п.
Мал. 2. Гістограма розподілу площі ядер в контрольній групі.
Розвитком міжм'язового набряку (4.06 ± 0,1 шкш і 1,11 ± 0,02 шкш; р<0,001) и увеличением толщины кардиомиоцитов (24,06 ±0,32 шкш и 22,90±0,41шкш; р<0,05 соответственно) также может быть объяснено некоторое увеличение толщины стенки левого желудочка в основной группе относительно контроля (соответственно 1,5±0,1 см и 1,3±0,04 см, р<0,05) Этими изменениями можно объяснить некоторую гипертрофию стенки левого желудочка в отсутствие существенного увеличения массы сердца.
Дані мікроморфометрін також дозволили виявити нерівномірне збільшення площі ядер кардіоміоцитів Середня площа ядер
кардна і оцітов у померлих раптово від гострих форм ішемічної хвороби серця склала 35,58 + 0,87 mkm2; в той час як в контрольній групі цей показник був на рівні 21.08 ± 0,52 ткт2 (р<0,001). При этом в основной группе площадь ядер варьировала от 10 до 80 ткт2, а в контрольной группе — от 10 до 30 ткт2.
Свого часу на можливість набухання або зморщування ядер кардіоміоцитів при гострих формах ішемічної хвороби серця звернули увагу Г.Г. Автандилов (1978) і Ю.Г. Целлариуса (1979), але не дали цього морфометрического підтвердження. Нами при морфометрическом дослідженні встановлено статистично значуще (р<0,05) увеличение толщины кардиомиоцитов в основной группе (24,06±0,32 ткт) по сравнению с контрольной (22,90±0,41 ткт). Это увеличение толщины кардиомиоцитов одновременно может сопровождаться гипертрофией и набуханием ядер. Для дифференциальной диагностики набухания и гипертрофии ядер кардиомиоцитов при скоропостижной смерти от острых форм ишемической болезни сердца необходимо проведение дальнейших исследований с использованием флюорисцентной и электронной микроскопии.
Узагальнюючи дані поляризационной мікроскопії нативних препаратів і світлової мікроскопії забарвлених препаратів, було встановлено, що у випадках смерті від гострої коронарної недостатності (38 спостережень) гостре ішемічне пошкодження кардіоміоіітов в 34 випадках (89%) локализовалось субендокардіальний, в 21 спостереженні (55%) - в інтрамуральних відділах і в 17 випадках (45%) - в субепікардіально відділах серця За топографії з однаковою частотою ішемічне пошкодження кардіоміоцитів виникало в передній стінці - 19 спостережень (50%), боковій стінці - 20 спостережень (52,6%) і задній стінці лівого шлуночка - 20 спостережень (52,6%). У меншій мірі локалізація процесу зачіпала верхівку лівого шлуночка - 16
спостережень (42%) і міжшлуночкової перегородки - 12 спостережень (31,6%).
При гострому інфаркті міокарда в донекротіческой стадії (9 спостережень) було встановлено, що гостре ішемічне пошкодження кардіоміоцитів в 8 випадках локализовалось субендокардіальний, в 7 спостереженнях - в інтрамуральних відділах серця, в 8 - субепікардіально. За топографії ішемічне пошкодження кардіоміоцитів виникало в передній стінці - в 4 спостереженнях, бічний і задній стінках лівого шлуночка - по 5 спостережень, а також з еерхушке лівого шлуночка - в 2 спостереженнях. У міжшлуночкової перегородки ішемічне пошкодження кардіоміоцитів нами не відзначено.
Таким чином, слід визнати, що при гострій коронарній недостатності ішемічне пошкодження кардіоміоцитів відзначається відразу в декількох (не менше трьох) топографічних областях серця без чіткої локалізації процесу. При цьому в першу чергу уражаються субендокардіальні зони міокарда, а з плином часу процес поширюється на інтрамуральні і субепікардіально області. На відміну від гострої коронарної недостатності, при раптової смерті від гострого
інфаркту міокарда в донекротіческой стадії ішемічний процес зачіпає одну - дві топографічні області лівого шлуночка з переважним трансмуральним ураженням стінки серця.
У перикардіальної рідини померлих раптово від гострих форм ішемічної хвороби серця загальна активність креатинкінази склала 45740 ± 14022 Од / л, в контрольній групі - 30888 ± 11278 Од / л (р\u003e 0,02). Активність серцевого ізоферменту креатинкінази від активності загальної креатинкінази склала відповідно 10,1 ± 2% і 10,3 ± 2% (р\u003e 0,02). Зміст міоглобіну в основній групі досягало 4535,5 ± 1405.2 нг / мл. а в контрольній - 2829 ± 1333 нг / мл (р\u003e 0,02). Активність загальної лактатдегідрогенази в основній групі була 12821 ± 2042 Од / л, в контрольній - 5772 ± 1580 Од / л (р<0,05). Активность аспартатаминотрансферразы в основной группе составила 3114,7±645,5 Ед/л, в контрольной — 734,7+184,4 Ед/л (р<0,001). Содержание сердечного тропонина 1 (cTnl) доходила в основной группе до 445,8 ± 85,9 нг/мл, в контрольной — до 175,8± 73,9 нг/мл (р<0.05).
Таким чином, в перикардіальної рідини при раптової смерті від гострих форм ішемічної хвороби серця достовірно підвищується вміст серцевих маркерів, як раннього - серцевого тропоніну I (cTnl), так і пізніх - аспартатамінотрансферрази і лактатдегідрогенази. Достовірних відмінностей в змісті креагінкінази і її серцевого ізоферменту, а так само міоглобіну не виявлено. Отримані результати узгоджуються з даними літератури [Мазуренко М.Д. Зіміна Ю.В. 1998; Берестовська Е.С. 2000, 2002], де зазначено, що в перикардіальної рідини серцеві маркери мають різну стійкість до посмертного аутолізу. Найменшою стійкістю до посмертного аутолізу мають креатинкиназа і її ізоферменти. Тому не були встановлені достовірні відмінності в їх змісті в перикардіальної рідини у осіб, померлих раптово від гострих форм ішемічної хвороби серця. В даний час «золотим стандартом» в клінічній практиці при гострих коронарних синдромах є визначення серцевого тропоніну I (cTnl).
Зіставлення даних мікроскопічного дослідження і результатів біохімічного дослідження перикардіальної рідини показує взаємозв'язок між мікроморфологічного змінами в серці і серцевими маркерами.
Кожна миофибрилла складається з двох типів поздовжніх филаментов (ниток). Перший тип ( «товсті» нитки) обмежені А-диском, вони складаються головним чином з білка міозину, в поляризованому світлі представляють світиться А-диск. Другий тип филаментов ( «тонкі» нитки) займає 1-диск, вони містять білки актин, тропонин (I, T, С) і тропомиозин. У поляризованому світлі це темні I-диски. Тропонин I виконує роль інгібітору скорочення кардіоміоцитів [Мшту J.M. 1974; Clark M. Spmdich J.A. 1977; Adelstein R.S. 1980; FuchsE. 1983].
Наявність контрактурних змін кардна іошггов (зближення анізотропних ділянок, зменшення товщини 1-дисків) 2 ступеня roeopirr про
надмірному скороченні міофібрил. Повне зникнення 1-дисків при контрактурних зміни кардіоміоцитів 3 ступеня говорить про розпад тропонннового комплексу та про втрати скорочувальної здатності кардіоміоцитів. Цим процесом пояснюється достовірне підвищення вмісту серцевого тропоніну I (cTnl) при гострих формах ішемічної хвороби серця. Втрата скорочувальної здатності міокарда відбувається також при розпаду на грудочки міофібрил і внутрішньоклітинному міошгголізе.
S. Yamamoto, S. Sawada (2000) встановили, що при гіпертрофії і ішемії кардіоміоцитів спостерігається висока активність лізосомальних структур з процесами цитоплазматичної дегенерації і підвищеною проникністю клітинних мембран в кардіоміоцитах шлуночків. При гострому ішемічному пошкодженні кардіоміоцитів розвивається підвищена проникність клітинних мембран, як цитоплазматических утворень, так і сарколеми кардіоміоцитів. Цим можна пояснити, що при раптової смерті від гострих форм ішемічної хвороби серця достовірно підвищується вміст серцевих маркерів
аспартатамінотрансферрази і лактатдегідрогенази. При цьому розпад тропонінового комплексу відбувається з одночасним підвищенням проникності лізосомальних і клітинних мембран, що веде в кінцевому підсумку до втрати скорочувальної здатності міокарда. Отримані дані підтверджують концепцію про мінімальний пошкодженні міокарда при гострій коронарній недостатності, висунуту поруч авторів.
Нам видається, що отримані нами дані можуть мати значення при розробці нових лікарських препаратів для лікування і профілактики гострих форм ішемічної хвороби серця, що перешкоджають розпаду тропонінового комплексу, що нормалізують функцію ендотелію коронарних артерій.
Таким чином, проведене дослідження дозволило встановити топографічні особливості поширення ішемічного пошкодження в лівому шлуночку серця при гострих формах ішемічної хвороби серця; а вивчені морфологічні ознаки розділити на патогномонічні, диференційно-діагностичні та малоінформативні; розробити диференційно-діагностичний алгоритм; простежити взаємозв'язки між ступенем стенозу коронарних артерій і характером морфологічних змін в міокарді, а також між змінами біохімічних показників перикардіальної рідини і морфологічними змінами в міокарді лівого шлуночка.
1. При раптової смерті від гострих форм ішемічної хвороби, як правило, відсутні виражені макроскопічні зміни. Для гістологічного дослідження необхідно проводити забір матеріалу за уніфікованою методикою з п'яти топографічних областей лівого
шлуночка серця - верхівки, міжшлуночкової перегородки, передньої, бічної і задньої стінок.
2. При гострій коронарній недостатності ішемія міокарда розвивається одночасно в не менше трьох топографічних областях лівого шлуночка. Частота її появи в передній стінці становить 50%, в боковій стінці -52,6%, в задній стінці - 52,6%, в міжшлуночкової перегородки - 31.6% і в верхівці серця - 42%. Разом з цим ішемічне пошкодження міокарда поширюється від субендокардіальних відділів (89%) через інтрамуральні (55%) в субепікардіально (45%).
3. У випадках гострого інфаркту міокарда в донекротіческой стадії ішемія серцевого м'яза розвивається одночасно в одній-двох топографічних областях лівого шлуночка, вражаючи в кожному другому випадку передню, бічну і задню стінку лівого шлуночка, в кожному п'ятому випадку верхівку серця. При цьому має місце трансмуральне поразка стінки лівого шлуночка серця.
4. Математичний аналіз 114 мікроскопічних ознак показав, що для діагностики гострої коронарної недостатності необхідна наявність одного патогномоничного ознаки - контрактурних змін кардіоміоцитів 3 ступеня і диференційно-діагностичних ознак в сумі понад +15,0 балів. Для встановлення діагнозу гострого інфаркту міокарда в донекротіческой стадії необхідне поєднання трьох патогномонічних ознак - контрактурних змін кардіоміоцитів 3 ступеня, первинного глибчатого розпаду і внутрішньоклітинного міоцітоліза і диференційно-діагностичних ознак в сумі понад + 15,0 балів.
5. Проведеним дослідженням встановлено, що при стенозі коронарних артерій серця, що становить більше 50% просвіту судини, поряд з гострими змінами - спазмом інтрамуральних артерій і набряком міжм'язового простору міокарда, так само відзначаються ознаки хронічного ураження - міжм'язової розростання сполучної тканини.
6. Комп'ютерна обробка зображення мікропрепаратів серця з подальшим морфометричних дослідженням показала, що при раптової смерті від гострих форм ішемічної хвороби серця відбувається нерівномірний збільшення площі ядер кардіомноцітов.
7. При раптової смерті від гострих форм ішемічної хвороби серця розвиток контрактурних змін кардіоміоцитів 3 ступеня, первинного глибчатого розпаду міофібрил і внутрішньоклітинного міоцітоліза супроводжується підвищенням в перикардіальної рідини рівня серцевого тропоніну I (сТп1), а при підвищенні проникності сарколеми кардіоміоцитів - збільшується активність аспартатамінотрансферрази (АсАТ ) і лактатдегідрогенази (ЛДГ).
Для діагностики гострих форм ішемічної хвороби серця - гострої коронарної недостатності і гострого інфаркту міокарда в донекротіческой стадії - доцільно:
1. Здійснювати забір матеріалу для гістологічного дослідження за уніфікованою методикою з 5-ти топографічних областей лівого шлуночка: верхівки, а також з міжшлуночкової перегородки, передньої, бічної і задньої стінок лівого шлуночка на рівні кола, що проходить через середину відстані між верхівкою і мітральним клапаном.
2. Після фіксації матеріалу в 10% розчині нейтрального формаліну, ущільнення в парафіні, досить фарбувати гістологічні зрізи гематоксиліном і еозином, хромотропом 2В водним блакитним за методом Н.З. Слінченко (1964) зі змінами, прийнятими кафедрою Санкт-Петербурзької медичної академії післядипломної освіти, досліджувати нефарбовані мікропрепарати в поляризаційному світлі.
3. При дослідженні мікропрепаратів використовувати диференційно-діагностичний алгоритм, що враховує наявність патогномонічних і диференційно-діагностичних ознак.
4. Для постановки діагнозу гострої коронарної недостатності необхідно: наявність патогномоничного морфологічної ознаки -контрактурних змін кардіоміоцитів 3 ступеня і диференційно-діагностичних ознак в сумі понад + 15 балів.
5. Для постановки діагнозу гострого інфаркту міокарда в донекротіческой стадії необхідно: обов'язкове поєднання патогномонічних ознак у вигляді контрактурних змін кардіоміоцитів 3 ступеня, глибчатого розпаду міофібрил і внутрішньоклітинного міоцітоліза, і наявність диференційно-діагностичних ознак в сумі понад +15 балів.
1. Резник А.Г. До питання про комп'ютерній обробці мікроморфології міокарда для діагностики ішемічного ушкодження кардіоміоцитів / А.Г. Резник, М.Д. Мазуренко // Теорія і практика судової медицини: Праці Петербурзького товариства судових медиків; Ред. проф. М.Д. Мазуренко. СПб, 2001. - Вип. 5. - С. 76-77.
2. Резник А.Г. Морфологічні прояви безпосередньої причини раптової смерті при ішемічній хворобі серця / А.Г. Резник, І.М. Іванов, М.Д. Мазуренко // Теорія і практика судової медицини: Праці Петербурзького товариства судових медиків; Ред. проф. М.Д. Мазуренко. СПб, 2002. - Вип. 6. - С. 77-80.
3. Резник А.Г. До питання про комп'ютерній обробці мікроморфології міокарда трупів осіб, померлих раптово / А.Г. Резник // Теорія і
практика судової медицини: Праці Петербурзького товариства судових медиків; Ред. проф. М.Д. Мазуренко. - СПб, 2002. - Вип. 6. - С. 82-84.
4. Резник А.Г. Мікроскопічна та комп'ютерна діагностика змін міокарда у трупів осіб. померлих раптово / Л.Г. Резник // Теорія і практика судової медицини: Праці Петербурзького товариства судових медиків; Ред. проф. М.Д Мазуренко. - СПб. 2003. - Вип. 7. - С. 9496.
5. Резник А.Г. Морфологічні зміни в міокарді і біохімічні показники перикардіальної рідини у померлих від ішемічної хвороби серця раптово / А.Г. Резник, І.М. Іванов, М.Д. Мазуренко та ін. // Теорія і практика, судової медицини: Праці Петербурзького товариства судових медиків; Ред. проф. М.Д. Мазуренко - СПб, 2003. - Вип. 7. - С. 9699.
6. Резник А.Г. Мікроморфологія міокарда прі »діагностиці безпосередньої причини раптової смерті від ішемічної хвороби серця / А.Г. Резник, І.М. Іванов, М.Д. Мазуренко // Проблеми експертизи в медицині. - 2003. - № 2. - С. 13-17.
Підписано до друку 13ог.с\u003e 4 Формат 60 × 84 "/ 16.
Обсяг 4% пл._Тіраж з екз._Заказ № ¿<о
Друкарня ВМедА, 194044, СПб. вул. Академіка Лебедєва, 6
За даними Московського регістра інфаркту міокарда, у віці 20-64 років майже у 90% померлих раптово була констатована ішемічна хвороба серця. Життя хворих на ІХС закінчується раптово в 50-60% випадків, за іншими даними до 80%) осіб, у яких наступила ВСС, до цього мали ті чи інші прояви ІХС. У молодих ВСС може мати коронарогенних генез внаслідок різкого спазму коронарних артерій навіть при відсутності коронарного атеросклерозу. При вивченні 200 випадків ВСС в 83,2% випадків знайдені важкі стенози коронарних артерій з звуженням просвіту не менше 75%, але без ознак ІМ. В інших спостереженнях у 36%\u003e був знайдений виражений атеросклероз коронарних артерій. У 23% виявлено аномалія провідної системи серця.
Ці дані дозволяють зробити висновок, що ненасильницька серцева раптова смерть найчастіше пов'язана з ІХС. У переважній більшості випадків - це гостра коронарна недостатність, яка призвела до фібриляції шлуночків або до зупинки серця через «арешту» синусового вузла, або атріовентрикулярної блокади.
Тому перед клініцистами стоїть важливе завдання ранньої діагностики ІХС та, перш за все, у хворих на стенокардію.
Ішемічна хвороба серця клінічно проявляється гострим коронарним синдромом в 60% про випадків, в 24% о - стабільною стенокардією і в 16% випадків - ВСС.
Залежно від патогенетичного механізму виділено кілька типів стенокардії: Стенокардія доставки, стенокардія споживання, непостійно-порогова стенокардія.
стенокардія доставки (Постачання) - виникає внаслідок порушення функціонування регуляторних механізмів, що призводить до появи епізодів ішемії через минущого зменшення доставки кисню, що є наслідком коронарної ва-зоконстрікціі. При фіксованому порозі стенокардії, викликаної підвищеною потребою міокарда в кисні з декількома вазоконстрикторні компонентами, рівень фізичної активності, необхідної для розвитку стенокардії, є відносно постійним. Ці пацієнти можуть чітко визначити ступінь фізичного навантаження, при якій у них розвинеться напад.
стенокардія споживання - обумовлена невідповідністю між надходженням крові і підвищеною потребою міокарда в енергетичних субстратах і кисні на тлі фіксованою обмеженою доставки кисню. Підвищення потреби відбувається за рахунок вивільнення адреналіну адренергічними нервовими закінченнями в результаті фізіологічного відповіді на напруження або стрес. Поспішність, вплив емоцій, хвилювання, психічний і розумовий стрес, гнів на тлі наявного звуження коронарних артерій, можуть шляхом різних складних механізмів приводити до приступу стенокардії. Збільшення потреби в кисні у пацієнтів з обструктивними змінами коронарних артерій виникає після їжі, при підвищенні метаболічних потреб внаслідок гарячкового стану, тиреотоксикозу, гіпоглікемії, тахікардії будь-якого генезу. У цих хворих ішемічним епізодами передує значне збільшення частоти серцевих скорочень. Імовірність ішемії пропорційна величині і тривалості частоти серцевих скорочень.
« Мінливо-порогова стенокардія»- у більшості хворих є звуження коронарних артерій, але важливу роль у розвитку ішемії грає обструкція, що викликається вазоконстрикцией. У цих пацієнтів є «хороші дні» (здатні виконувати значне навантаження) і «погані дні», коли мінімальне навантаження призводить до клінічних та ЕКГ проявів. У них відзначається варіабельність стенокардії, яка частіше буває вранці. Погіршення толерантності до фізичного навантаження після їжі - результат швидкого наростання потреби міокарда в кисні.
На практиці частіше зустрічається « змішана стенокардія», Яка займає проміжне місце між стенокардією з певним порогом і не постійно-порогової стенокардією і поєднує елементи« стенокардії потреби »і« стенокардії доставки ».
Існує група пацієнтів, у яких напади ішемії супроводжуються невеликим дискомфортом за грудиною, а переважна більшість епізодів ішемії виявляється на ЕКГ. У більш рідкісних випадках у пацієнтів з наявністю атеросклеротичних пошкоджень коронарних судин ніколи не виникає почуття болю, навіть при розвитку інфаркту міокарда, тільки зміни на ЕКГ. В одному з досліджень наводяться дані про розвиток безболевого Q-інфаркту навіть у чверті спостерігалися хворих з таким інфарктом.
При безбольової ішемії передбачається дефект «системи оповіщення»:
- це може бути результатом комбінації підвищення порога чутливості до больових стимулів і коронарної мікроваскулярного дисфункції;
- ще одне припущення про розвиток безбольової ішемії -велика концентрація ендогенних опіатів (ендорфінів), які підвищують больовий поріг;
- у хворих на цукровий діабет є залежність безбольової ішемії і вегетативної нейропатії.
при прихованих формах ураження серця, Незважаючи на відсутність порушень серцевого ритму, в міокарді розвиваються виражені порушення метаболізму і ультраструктури. Ці зовні не-які проявляються процеси можуть бути небезпечні для життя, оскільки і самі по собі, а тим більше при появі будь-яких додаткових чинників, про які ми вже говорили, можуть зумовити виникнення різних серцевих аритмій аж до фібриляції шлуночків і настання ВСС. До таких додаткових факторів, що викликають електричну нестабільність серця, найчастіше відносяться:
- поява ішемічної зони на тлі рубцевих змін міокарда,
- підвищення активності симпатоадреналової системи,
- збільшення концентрації іонів вільного натрію і зниження концентрації іонів вільного калію в міоцитах.
Епізодами безсимптомної ішемії надається серйозне прогностичне значення: якщо в умовах проби з фізичним навантаженням у хворого без клінічних проявів ІХС на ЕКГ виявляються ті чи інші патологічні зміни, то протягом найближчих 5 років у 85% таких осіб з'являються або синдром стенокардії, або настає ВС.
У більшості випадків ВСС (При відсутності даних за будь-яке інше попереднє захворювання) може розглядатися як летальний результат приховано протікала ІХС. Це означає, що тільки цілеспрямоване розпізнавання приховано протікає ІХС і в проведенні адекватних заходів з профілактичного обстеження чоловіків у віці від 40 років і старше може допомогти у своєчасному попередженні фатальних наслідків.
Якщо у таких хворих провести холтерівське моніторування або пробу з фізичним навантаженням і реєстрацією ЕКГ, то в переважній більшості випадків у них можна виявити «німу» ішемію міокарда.
У пацієнтів з ішемічною хворобою серця, Які перенесли інфаркт міокарда, шлуночковіекстрасистоли розглядаються як потенційно злоякісні шлуночкові аритмії. Якщо ризик раптової смерті у такого хворого приять за одиницю, то наявність у нього лише 10 одиночних шлуночкових екстрасистол за годину як незалежний фактор підвищує цей ризик в 4 рази. Якщо при цьому фракція викиду лівого шлуночка (інший незалежний фактор) менше 40%, то ризик зростає в 16 разів.
| Статті по темі: | |
|
Застосування білкового крему
Постійні читачі добре знаю мою любов готувати і смачно поїсти з ... Симптоми лактозной недостатності у дорослих
Непереносимість лактози - клінічно виражене стан, пов'язаний з ... Як Майні біткоіни - суть процесу і з чого почати, види і прибутковість заробітку
Напевно майже кожен, хто тільки починає знайомитися з біткоіни, ... | |